如何为监管核查做准备
概述
为针对临床试验中所使用的EDC系统的相关文档进行的监管核查做好充分准备是非常重要。如果有正确的文档供监管部门核查,并且已经进行了相关验证,监管核查人员就可以评估在临床试验中收集受试者数据时使用的系统。
根据监管部门的不同,申办方还必须满足其特定要求,EMA GCP检查员工作组(EMA GCP IWG)、FDA(食品和药物管理局)和PMDA(日本药品和医疗器械管理局),虽然他们在希望申办方对系统有充分了解的角度上是相似的。他们还希望申办方(或受委托的合同研究组织(CRO))对所使用的EDC系统有充分的了解,并可以基于理解对系统如何验证做出相关解释和说明。
Viedoc监管核查准备包
为了帮助您准备监管核查,Viedoc为您准备了Viedoc监管核查准备包(VIRP),它为您提供了满足监管核查期望和要求所需的信息。
VIRP与Viedoc的每次更新同步发布。VIRP简介中包含了描述VIRP内容的更多详细信息,还解释了您需要提供的其他文档。VIRP简介就包括在VIRP中。
VIRP中包含的文档:
- User Requirements Specification 描述epics1和功能1,并列出了发布中包含的用户示例1。
- Traceability Matrix 详细说明对URS中每个需求进行的测试。
- Validation Summary Report 描述为该发布进行的验证活动和结果。
- Release Notes 描述Viedoc在本次发布中的新增内容。
- Release Certificate 证明我们在实施发布的更新和相关活动中遵循了我们记录的程序。
- EDC Management Sheet 用于提交给PMDA。
- Clinical Trial Cloud System Checklist
- Viedoc Impact Assessment 从每个系统更新的功能的角度记录当次Release中所包含的新功能可能带来的影响和风险。
- VIRP Change Summary 描述当次Release在VIRP文档中引入的变化
- Acknowledgement Form 用以说明您需要审核的内容,并包括供您签名的位置,以证明您已完成审核。您可以在Viedoc的每个新发布中使用此表单,以证明您不需要重新验证研究设置。这意味着,新发布中的内容并不会影响您的研究设置。完成签署的表单应作为研究文档的一部分保留在申办方的(e)TMF中,并可向监管核查人员出示,以尽量减少稽查中发现问题的风险。
- Table of Contents 是Viedoc Technologies在制作本发布内容时使用的SOP。
- 简介,描述Viedoc监管核查准备包(VIRP)的内容。
其他资源:
- eLearning:Viedoc还提供了一个eLearning课程 - Inspection Readiness When Working in Viedoc,其中详细描述了每个步骤中所需的信息,同时包含潜在风险信息,比如,当一个发布中有新功能被引入时会发生什么,关于反向兼容性等等。
- Viedoc Release Binder。我们还为每个发布在我们的开发环境中存储了一个信息快照。这些信息包括在该发布的Release Binder中,并存储在SharePoint以便在网络研讨会上或现场与监管核查人员分享。
责任分布
当涉及到准备监管核查时,申办方/CRO和Viedoc有不同的责任分布。
Viedoc的责任
由于不会有任何申办方或研究特定的软件修改被应用在标准产品上,申办方/CRO可以依赖Viedoc标准认证文件。研究中所使用的Viedoc配置都是在发布给研究前经过验证的。
每个新的Viedoc版本在发布前都要经过充分验证 - 约每6-8周发布一次。这些发布同时安装在所有的正式服务器上,这意味着所有的客户和所有的研究都可以在同一时间得到更新。此外,我们通过满足下列两个条件,确保正在进行的研究不受影响:
- 新发布必须是100%反向兼容的。
- 发布中的任何新功能都应默认禁用于正在进行的研究。
申办方/CRO的责任
然而,依然有一些领域和活动是申办方/CRO的责任,应予以记录:
- 验证研究配置并确认研究配置符合研究方案的要求是申办方/CRO的责任。应予以记录。
- 研究期间使用的不同版本的系统以及不同版本之间的差异概要应作为研究记录的一部分保存在申办方(e)TMF中。
- 执行风险评估时,应记录信任VIRP的内容。
- 在我们的epic1层级上为您的试验准备一份所需的功能的清单(如随机化模块、患者ePRO模块、编码模块),并在必要时提供个别功能1。
核查当天需要做什么
当监管核查人员来访时,他们必须能够访问Viedoc。监管核查人员有权查看研究中的所有数据 - 甚至是患者数据和稽查轨迹中的隐藏(匿名)内容。Study Manager应在监管核查人员到达时邀请其作为Viedoc中的监管核查人员的用户角色。
按照以下步骤,确保监管核查人员有适当的权限来访问Viedoc:
Viedoc Designer
本步骤由Designer进行。
在Viedoc Designer中的角色页面,设置监管核查人员的用户角色,并确保其处于开启状态。
为了让监管核查人员能够访问研究数据,必须将该角色在角色页面上设置为只读表单数据、查看匿名数据和隐藏数据。
Viedoc Logistics
如果研究使用Viedoc Logistics,必须在角色页上为监管核查人员角色配置Logistics权限中的下述角色权限:
- 在研究层级上查看IP(临床试验药品)
- 查看中心层级的IP
- 查看已经分配的受试者ID
- 查看隐藏信息(例如:研究药物/安慰剂)
参见下图和配置角色。

注意! 如果监管核查人员也需要访问Viedoc Admin或Viedoc Designer,并且该研究由Viedoc代表管理,如果您需要帮助,欢迎随时联系您的Viedoc代表。
Viedoc Admin
这些步骤由Study Manager执行。
在 Viedoc Admin中,Study Manager 邀请监管核查人员加入所有研究中心。参见管理用户。
- 监管核查人员也应该被邀请作为研究的Unblinded Statistician,以便能够访问和在Viedoc Admin中下载随机列表。
注意! 当有必要控制可以访问和管理随机列表的人员,此角色只用于有随机化的研究。
- 监管核查人员也应该能够访问eLearning。有一项要求是,客户必须能够应要求向监管核查人员出示在研究过程中用于培训工作人员的eLearning版本。
研究设置下的文件标签提供了所有文件和培训章节的列表。
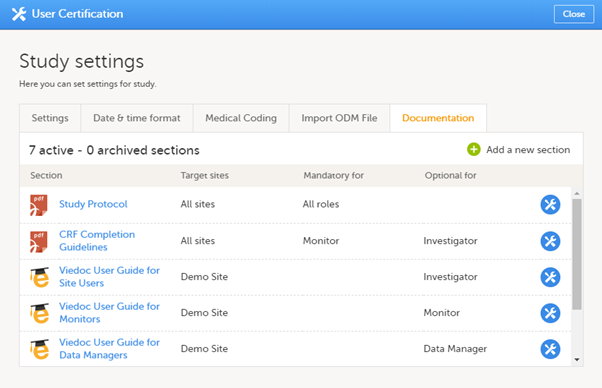
在研究设置页面上的相关eLearning文件也应邀请监管核查人员角色浏览。
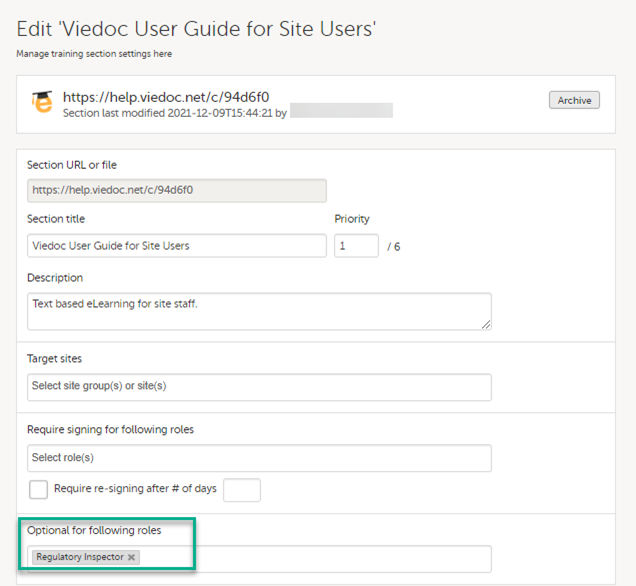
见Viedoc Admin 用户指南 设置用户文档学习和培训。
Viedoc eTMF
当在研究中使用Viedoc eTMF时,Study Manager/eTMF管理员应将监管核查人员研究角色映射为eTMF角色,并至少有以下权限:Read-only TMF Admin, Read-only Trial Master File 和 Download audit trail。
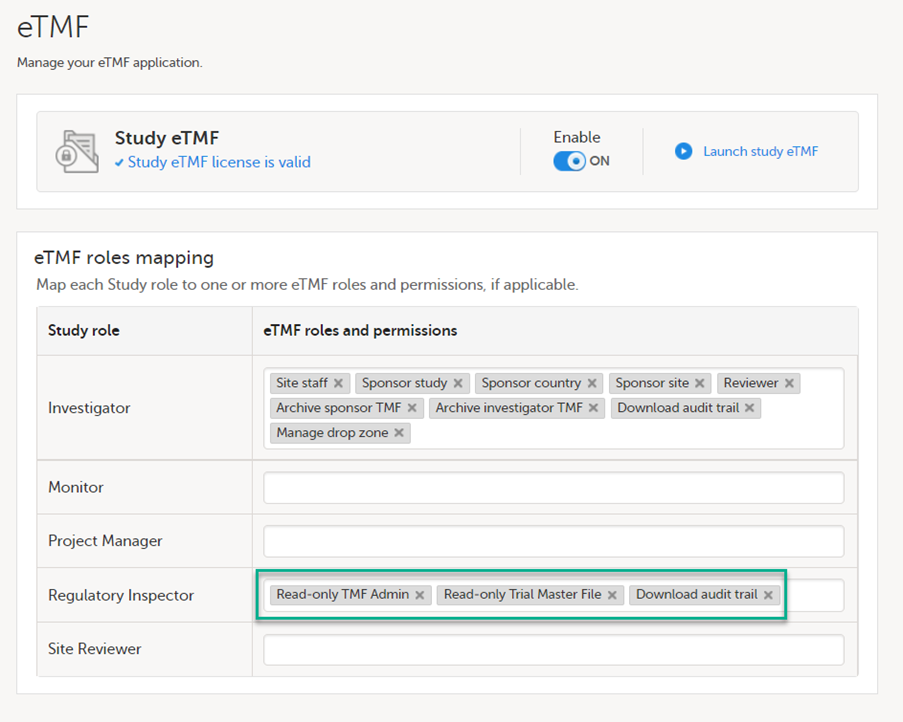
参见Viedoc eTMF Manager用户指南 - 管理Viedoc eTMF - 映射用户角色。
Viedoc Clinic
这些步骤由监管核查人员执行。
监管核查人员接受邀请并激活账户 - 参见Viedoc中心用户指南:管理您的Viedoc账户。
核查人员现在可以从登陆页面启动Viedoc Clinic和Viedoc eTMF。
注脚
1在Viedoc,我们以一种易于理解的方式发布我们的User Requirements Specification,由epics、功能和用户示例组成。
- Epics描述了Viedoc的一个整体模块,如稽查轨迹、ePRO和医学编码。
- 功能是对某一特定功能的详细描述,如Viedoc Connect,表单链接项,和电子邮件提醒。
- 用户示例是系统开发人员在设计、实施和验证Viedoc时使用的详尽的细分需求。
