規制当局の査察への対応準備
はじめに
臨床試験で運用しているEDC システムに関する文書の査察に十分備えておくことは、非常に重要です。正しい文書が規制当局のレビューに用意されていて、ある程度のバリデーションが実施されていれば、査察官は臨床試験で被験者のデータの収集に使用するシステムを評価することができます。
また、欧州医薬品庁 (EMA)、食品医薬品局 (FDA)、医薬品医療機器総合機構 (PMDA) は、スポンサーがシステムを完全に理解していることが求められる点では共通しているものの、それら規制機関によってスポンサーが遵守すべき特定の項目があります。また、スポンサー(委託された場合は医薬品開発業務受託機関(CRO))が使用するEDCシステムの機能を完全に理解し、その理解度を示し、システムがどのようにバリデートされたかを説明できることが求められます。
Viedoc 査察準備パッケージ
査察の準備を支援するために、Viedocは薬事審査準備パッケージ(VIRP : Viedoc Inspection Readiness Packet ) を用意し、規制当局から求められる期待や要件を満たすために必要な情報を提供しています。
VIRPは、Viedocのすべてのリリースで利用可能です。VIRP Introductionでは、VIRPの内容をより詳しく説明し、また、提供すべき追加文書についても触れています。VIRP Introductionは、VIRPに含まれています。
VIRPに含まれるドキュメント
- User Requirement Specification(URS:ユーザー要求仕様書):エピックと機能について記述し、リリースに含まれるユーザーストーリーが列挙されています。
- User Requirement Traceability Matrix: URSの各要件に対して実施されたテストを詳細に記載しています。
- Validation Summary Report:本リリースに対して実施された検証活動とその結果を記載しています。
- Release Note: 本リリースにおけるViedocへの追加を記載しています。
- Release Certificate: 本リリースの実装および関連作業において、文書化された手順に従って実施されたことを証明するものです。
- EDC Checklist: PMDAへ提出するための申請用EDC管理シート(英語版と日本語版)です。
- Clinical Trial Cloud System Checklist
- Viedoc Release Impact assessment: リリースにおける新機能および更新機能のリリースから生じるリスクと潜在的な結果を機能レベルで文書化しています。
- VIRP Change Summary: 特定のリリースにおいて VIRP に加えられた更新内容を記載します
- Acknowledgement Form: 確認すべき事項を説明し、確認を完了した証拠として署名欄を設けています。
- Viedoc Quality System TOC: Viedoc Technologies が本リリースの作成に使用した該当するSOPの目次です。
- VIRP Introduction:Viedoc薬事申請準備パッケージ(VIRP)の内容の説明です。
その他のリソース
-
eLearning: ViedocはeLearningレッスン - Viedocでの申請準備 も提供しており、必要な情報をステップバイステップで詳しく説明し、さらに潜在的な落とし穴、リリースで新しい機能が導入されたときのこと、後方互換性についてなどの追加情報も持っています。
- Viedoc Release Binder: 各リリースの開発環境における情報のスナップショットを保存しています。この情報は、SharePointに保存されているリリースのRelease Binderに含まれ、ウェビナーやオンサイトで監査官と共有することができます。
責任範囲
規制当局による査察の準備に関しては、スポンサー/CROとViedocで担当する領域が異なります。
Viedocの責任範囲
標準製品にスポンサーや試験特有のソフトウェアの変更ないため、スポンサー/CROはViedocの標準資格証明書を信頼することができるはずです。試験で使用するViedocの設定は、試験にリリースされる前にバリデーションされた機能のみを使用して行われます。
Viedocの各新バージョンはリリース前に完全にバリデーションされ、6~8週間ごとに実施されます。これらのリリースは、すべてのプロダクションサーバーに同時にインストールされます。つまり、すべての顧客とすべての試験が同時にアップデートされます。さらに、次の2つの要件を満たすことで、進行中の試験に影響を与えないようにしています。
- 新しいリリースは、100%後方互換性があること。
- そのリリースに含まれる新機能は、進行中の試験に対してデフォルトで無効化されること。
スポンサー/CROの責任
いくつかの領域及び活動は、依然としてスポンサー/CRO の責任であり、文書化する必要があります。
- 試験の設定をバリデーションし、試験実施計画書に従って試験が設定されたことを確認することは、スポンサー/CRO の責任である。このバリデーションは文書化される必要があります。
- 試験中に使用されたシステムの異なるバージョン及びバージョン間の違いの概要は、スポンサーの(e)TMF に試験記録の一部として保存されるべきです。
- VIRP に依存する決定を文書化したリスクベースの評価が実施されるべきです。
- 試験に必要な機能(無作為化モジュール、患者ePROモジュール、コーディングモジュールなど)を当社のEopic1レベルでまとめたチェックリストと、必要に応じて個別のFeature1のチェックリストを用意すべきです。
査察当日にすべきこと
査察官が訪問する際には、Viedocにアクセスできるようにしておく必要があります。規制当局の査察官は、被験者データや監査証跡の隠れた(匿名化された)項目も含め、試験内のすべてのデータを閲覧する法的権限を有しています。治験責任者は、査察官をViedocユーザーロール Regulatory Inspectorとして招待する必要があります。
以下の手順に従って、査察官がViedocのすべての正しいアクセス権限を持っていることを確認してください。
Viedoc Designer
このステップはDesignerで実行します。
Viedoc Designerのロールページで、Regulatory Inspectorユーザーロールを設定し、それがオンになっていることを確認します。
Regulatory Inspectorロールが試験データにアクセスできるようにするには、ロール設定ページで、フォームデータの閲覧のみ、匿名化データの表示および盲検情報の表示の許可をロールに設定する必要があります。
Viedoc Logistics
試験がViedoc Logisticsを使用する場合、ロールページで、次のロジスティックロール権限をRegulatory Inspectorロールに設定する必要があります。
- IP(Investigational Product) を試験レベルで表示
- IPをサイトレベルで表示
- 割当時に患者IDを表示
- 盲検情報の表示(例・アクティブ/プラセボ)
以下の画像とロール設定を参照してください。

注意! 査察官がViedoc AdminやViedoc Designerへのアクセスも必要とし、試験がViedocの担当者によって管理されている場合、サポートが必要であればいつでもViedocの担当者に連絡してください。
Viedoc Admin
これらの手順は、スタディマネージャによって実行されます。
Viedoc Adminで、スタディマネージャーは、すべてのサイトについて、Regulatory Inspectorロールを試験に招待します。ユーザーを管理する を参照してください。
- 査察官は、無作為化リストにアクセスし、Viedoc Adminでダウンロードできるようにするため、非盲検統計学者のロールで試験に招待されることも必要です。
注意! このロールは無作為化試験においてのみ使用され、誰が無作為化リストにアクセスし、管理できるかを制御する必要がある場合に使用されます。
- 査察官がeLearningにアクセスできるようにする必要もあります。顧客が規制当局の査察官に、要求に応じて、試験の過程でスタッフのトレーニングに使用されたeLearningのバージョンを提示できることが要求されています。
試験設定のドキュメンテーションタブには、すべてのドキュメントとトレーニングセクションのリストが表示されます。
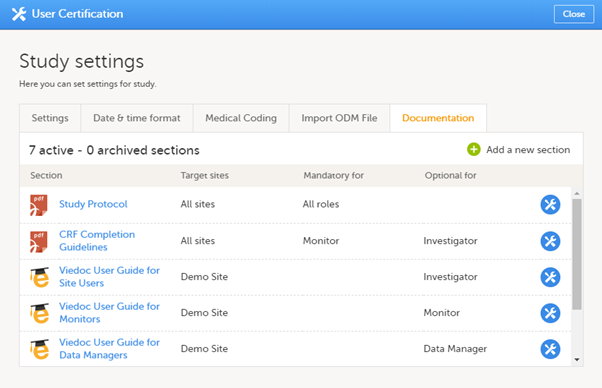
Regulatory Inspectorロールは、Study settingsページで関連するeLearningドキュメントへのアクセス権を付与される必要があります。
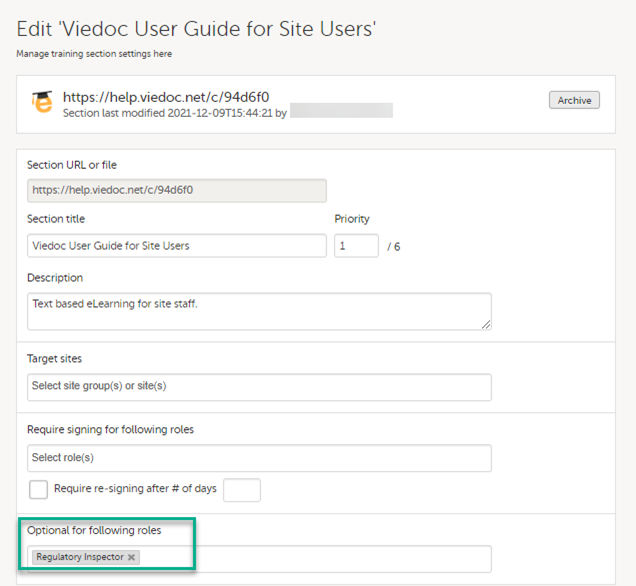
Viedoc Admin ユーザーガイドのドキュメントとトレーニングを設定するを参照してください。
Viedoc eTMF
試験がViedoc eTMFを使用する場合、スタディマネージャ/eTMFマネージャは、Regulatory Inspectorロールを、少なくとも以下の権限を持つeTMFロールにマッピングする必要があります。
- Read-only TMF Admin
- Read-only Trial Master File
- Download audit trail
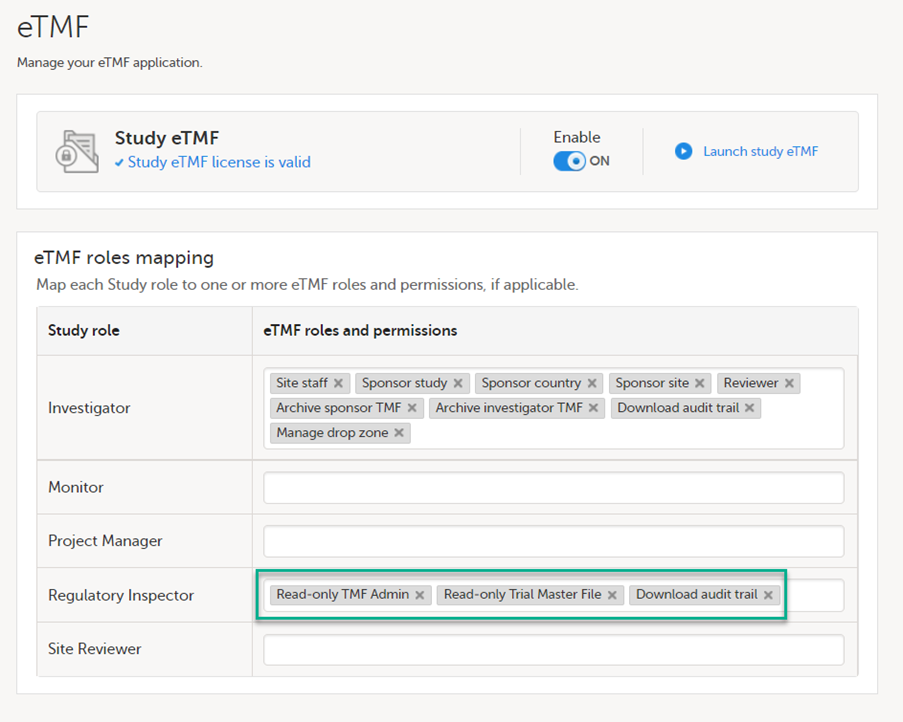
Viedoc eTMFユーザーガイド・管理者用 - Viedoc eTMFの管理-ユーザーロールのマッピングを参照してください。
Viedoc Clinic
これらの手順は、規制査察官が実行します。
規制査察官は招待状を受理し、アカウントを有効にします - Viedocユーザーガイド・施設向け: Viedocアカウントを管理する を参照してください。
査察官は、ランディングページからViedoc ClinicとViedoc eTMFを起動することができます。
脚注
1 Viedocでは、ユーザー要求仕様書を、Epic、Feature、User Storyからなる分かりやすい形式で公開しています。
-
Epicは、監査証跡、ePRO、医療コーディングなど、Viedoc内のモジュール全般を説明します。
- Featureは、Viedoc Connect、フォームリンク項目、電子メールアラートなど、与えられた機能をより詳細に記述します。
- User Storyは、システム開発者がViedocを設計、実装、バリデーションする際に使用する、詳細かつ細分化された要件です。
