Viedoc and eSource Direct Data Capture (DDC)

はじめに
「eSource」と「DDC」という用語は何年も前から存在していますが、以前にも増して一般的になってきているように思われます。この文書の中では、「eSource Direct Data Capture」または「eSource DDC」という用語は、臨床データを取得するために特別に検証された電子システムに、診察時に治験責任医師や施設スタッフが原データを直接入力することを指します。
ViedocはeSource DDCに関して多くのメリットがあります。まず第一に、ViedocはeSourceを管理するためのアプリを必要としないため、アプリとEDC間でデータを同期する必要がありません。第二に、ViedocのeSource機能は標準ライセンス料に含まれているため、余分なコストがかかりません。最後に、完全な、または部分的なeSourceデータ収集のための試験のセットアップは、 eSourceフォーム無しの試験セットアップより時間がかかるということはありません。
eSourceとしてデータを入力したサイトとそうでないサイトを、同じ試験で同じフォームを使用して混在させることも可能です。さらに、Viedocを使用して eSource データを収集する際には、Viedoc eClinical スイートに含まれる機能をフルに活用することができます。
この文書の目的は、ViedocがどのようにeSource DDCにネイティブに最適化されているのか、そして、Viedocの利用者としてお客様は何を意識する必要があるのかを説明することです。
背景
EMAは、2019年7月25日のeSource Direct Data Capture (DDC)に関するガイドラインにおいて、eSource DDCシステムとアプリケーションが容認されるためには、現地の法的規制とICH GCPに沿ってカスタマイズされ、検証され、ユーザーアクセプタンステストが実施され、安全性が確保され、維持されている必要があると述べています。
EDCシステムは、試験プロトコルで定義および承諾されている場合、直接データを入力する完全な、または部分的なeSourceとして長年使用されており、eSourceシステムの規制はすでに既存のガイダンスによって間接的に広範囲にカバーされています。
eSource DDCコンセプトの重要な点は、患者の安全、データの完全性、および臨床研究の運用効率を向上させ、新しい治療法をより早く患者に届けることです。EHRシステムからデータを転記するのではなく、臨床的評価データ(および他のデータ)をビジット中に直接EDCシステムに入力することは、このコンセプトの達成に役立ちます。一方でeSource DDCアプローチはまた、EDCシステムに臨床試験プロトコルで要求されていない情報、または匿名化されていない個人情報が入力される可能性があることを意味します。このようなデータは、プロトコルで定義された、特定のデータのみを受け取るスポンサーと共有されてはなりません。
Viedocは2004年のリリース時からeSource DDCをサポートしており、ソースデータを直接EDCに入力できるようにすることで、サイトスタッフとモニター両方の作業負荷を軽減しています。高度に設定可能なロールベースでの権限付与システムにより、特定のロールのみが特定のデータにアクセスできるようになります。また、データの取扱いに関しては柔軟なオプションが用意されているため、Viedoc利用者は、患者のカルテに記入する日常的なドキュメンテーションを修正するために、医師が使用していたような従来の治験用ワークシートに代わる電子ワークシートを設定することができます。このデータの認証されたコピーは、速やかにサイトの EHRシステムにアップロードしたり、患者の紙カルテのコピーとして保管したりすることができます。サイトはそれぞれ異なるため、サイトがどのようにシステムにデータをアップロードすべきかについては、柔軟なアプローチを保つことが重要です。
2014年のViedoc Clinicのリリースに伴い、Viedocはタブレット端末での利用に最適化されました。同年には、患者が携帯電話やタブレットなどのモバイルデバイスから直接入力が可能な、eSource DDCの可能性を追加したViedocMeがリリースされました。
次の章では、eSource DDC 用に最適化された Viedoc のネイティブ機能の特徴について、また、患者のプライバシー権から規制コンプライアンスまで、すべてを網羅する重要なトピックについて説明します。
定義
以下の定義は、2013年9月に発行されたFDAのガイダンス"Guidance for Industry Electronic Surveillance CIinicaI Investigations"から引用しています。
|
Data element(データ要素) |
eCRFのデータ要素とは、治験において被験者に関して取得した最小単位の所見である。データ要素の例としては、人種、白血球数、 pain severity measurement、等の治験中に得られ、記録される治験の所見が挙げられる。 |
|---|---|
|
Data originator(データの発生源) |
各データ要素は、認可されたデータの発生源と関連づけられる。データの発生源の例としては、以下が挙げられる。治験責任医師、及び権限移譲された治験スタッフ、EHRシステム、中央検査室、ePROシステムなど。 |
|
eSource(電子原データ) |
電子原データ 最初から電子形式で記録されるデータ |
|
DDC |
eCRFへの直接入力。 治験における多くのデータ要素(血圧、体温、錠剤の数、症状や兆候への対処)はビジット時に入手でき、認可されたデータの発生源がeCRFに直接入力することができる。これらのデータ要素については、eCRFがSourceとなる。 |
eSource DDCシステムの重要な側面
ロールベースのアクセス
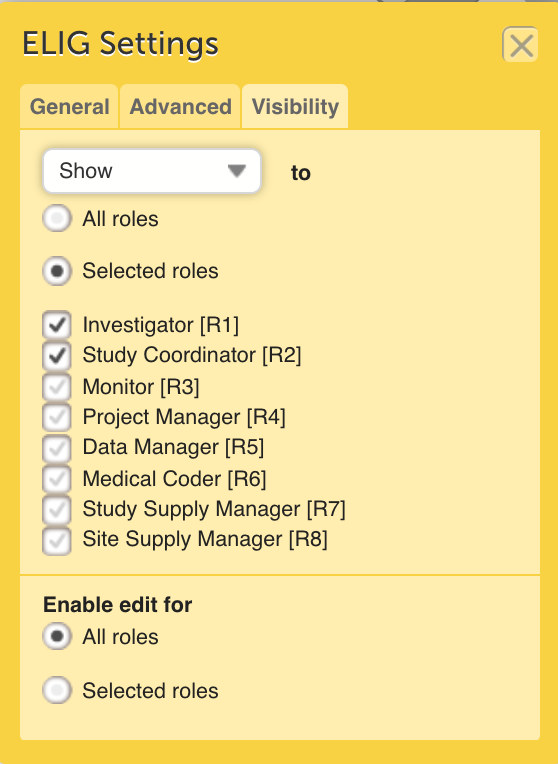
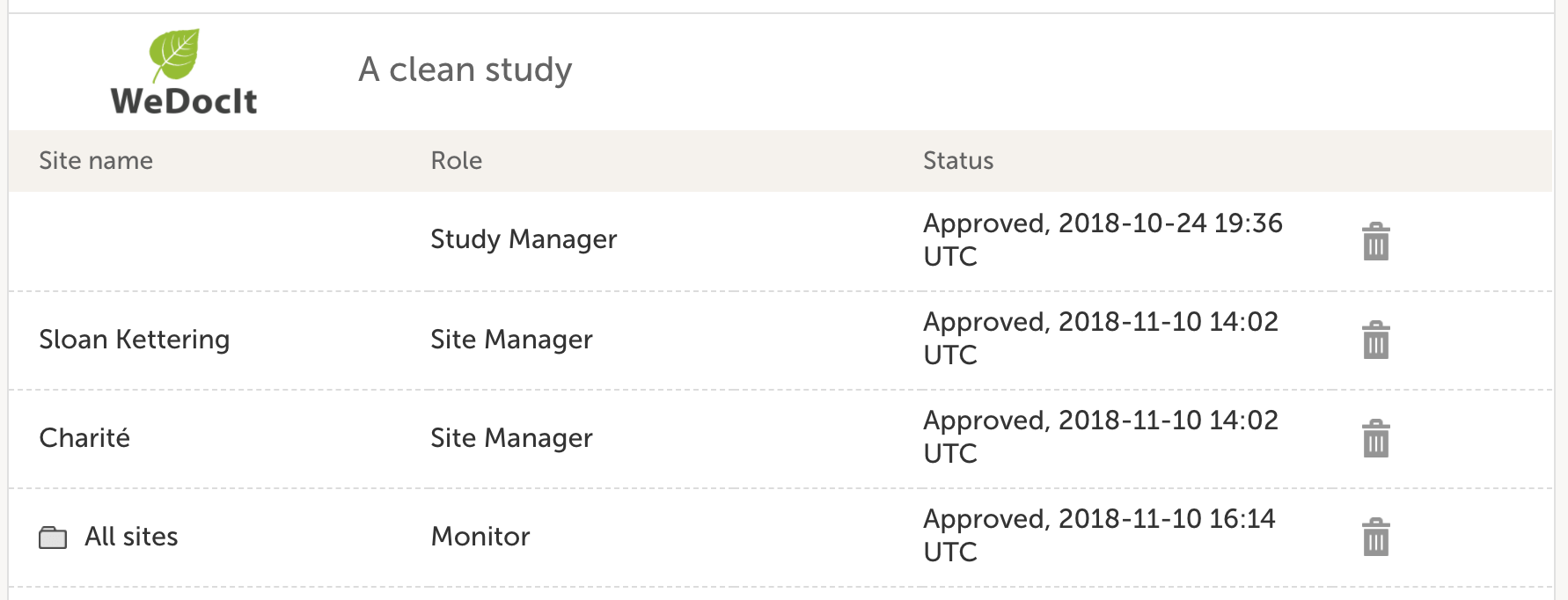
Viedocの核心は、臨床データの機密性、完全性、可用性にあります。ロールベースでの権限付与ができ、データ分離の設定が可能です。ロールは高度に設定でき、最小特権の原則に従ったプロジェクトを可能にします。この原則は、治験依頼者側のユーザーが個人を特定できる情報(PII)にアクセスすることができず、各治験参加者にサイトが割り当てた固有の患者番号のみを閲覧することができるため、患者のプライバシー権を保証します。
独立した同時コピー
Viedocはデータの保存と同時に、データのPDFコピーを生成します。さらに、データはスポンサーの単独管理下にあるサーバーに保存されるのではなく、Viedocのサーバー内に保存され、治験従事者はいつでもアクセスすることができます(法的には治験従事者のサイトに保存することに相当します)。
情報セキュリティ
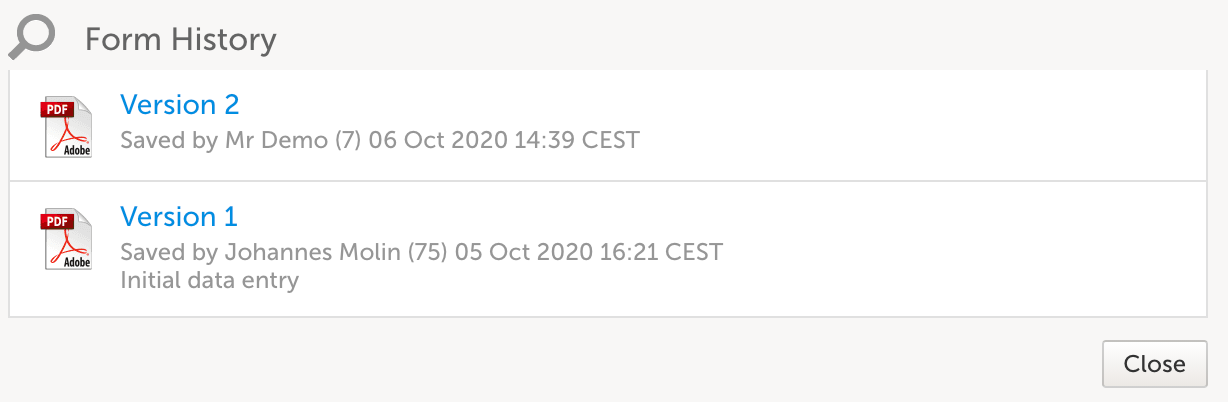
ロールベースでの権限付与システムは、多要素認証と、ユーザーアクセスの委任プロビジョニング/デプロビジョニングのための洗練されたシステムを組み合わせて、Viedocの情報セキュリティの中核となり、最小特権の原則をサポートしています。
暗号化は、送受信中と保存中の両方に適用されます。多要素認証は、プロジェクトレベルで利用することができますが、ユーザーレベルで任意に有効にすることもできます。Viedoc の機能は、委任されたアクセス管理のアプローチを奨励しており、これにより、不正なアクセス権限や古いアクセス権限を認識することが可能になります。
現地の規制
Viedoc の eSource DDC のアプローチは、(可能な限り)ビジット中のプライマリ・データ
エントリポイントとして Viedoc を使用すべきであるというものです。しかし、現地の規制などでEDCシステムをプライマリ・データエントリポイントにできない場合、そのサイトスタッフはViedocにデータを転記する前に、ソースデータのロケーションリストにその旨を記載しておく必要があります。
データの変更と修正
eCRF データの変更や修正は、治験責任医師または委任された治験従事者のみが行うべきです。治験責任医師がデータ修正の情報を得たり、承認したりする方法は、Viedoc内で制御されたプロセスによって管理されており、データの整合性に影響を与える可能性のある eCRF への改訂を治験責任医師が確認する必要があります。治験責任医師は改訂内容を確認し、eCRF が改訂される前に、変更の影響を十分に理解していることを承認します。
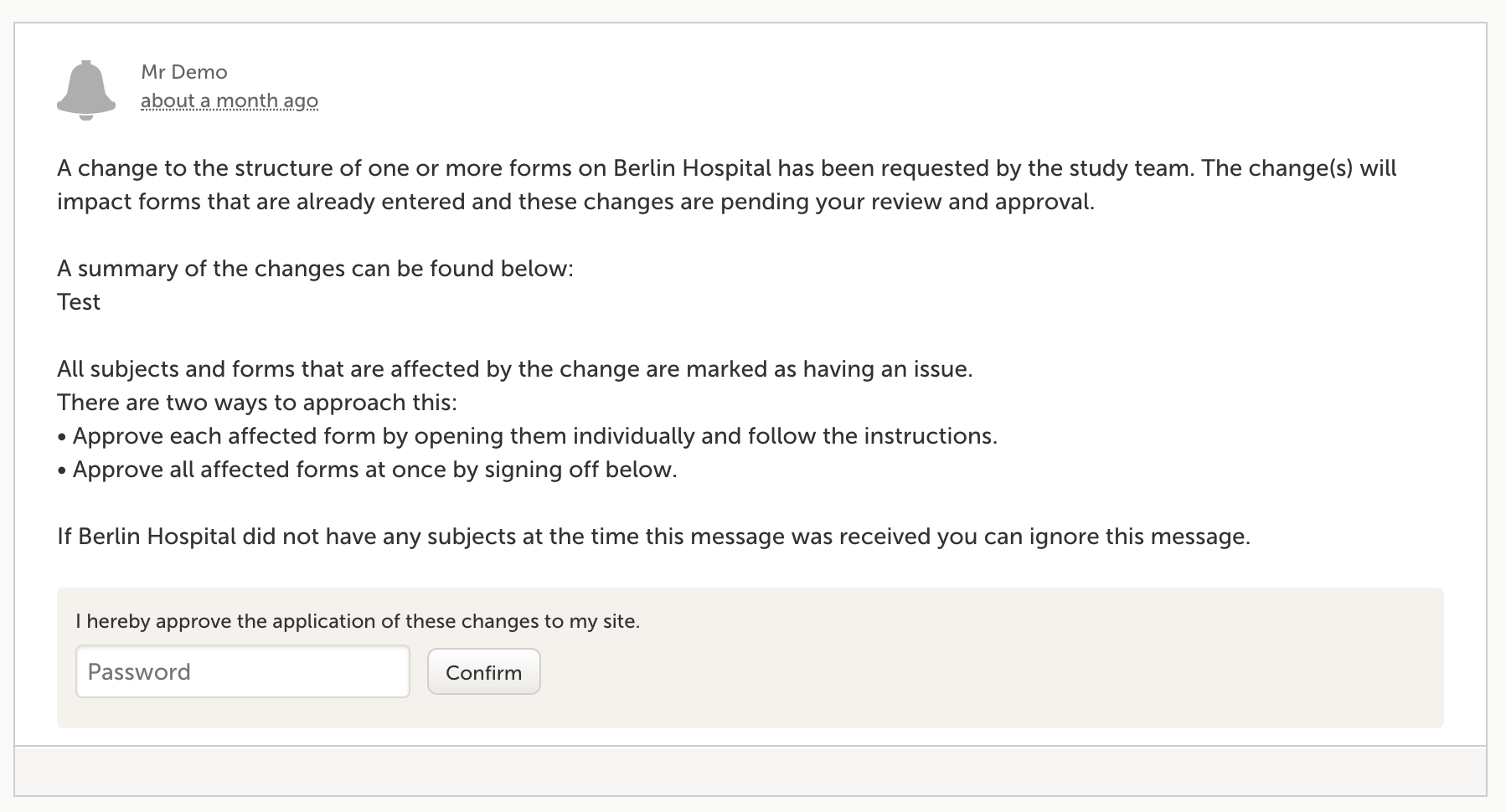
複数の試験デザインを管理する
一つの試験に複数のプロジェクトデザインを同時に適用が可能であり、また、一人の患者に異なるデータ収集のタイムポイントで複数のプロジェクトデザインを適用できることは、Viedocのユニークな特徴ある機能の1つです。これにより、患者データの収集/保存をサイトごとに設定して、任意のデータのみ収集されるようにすることができます。
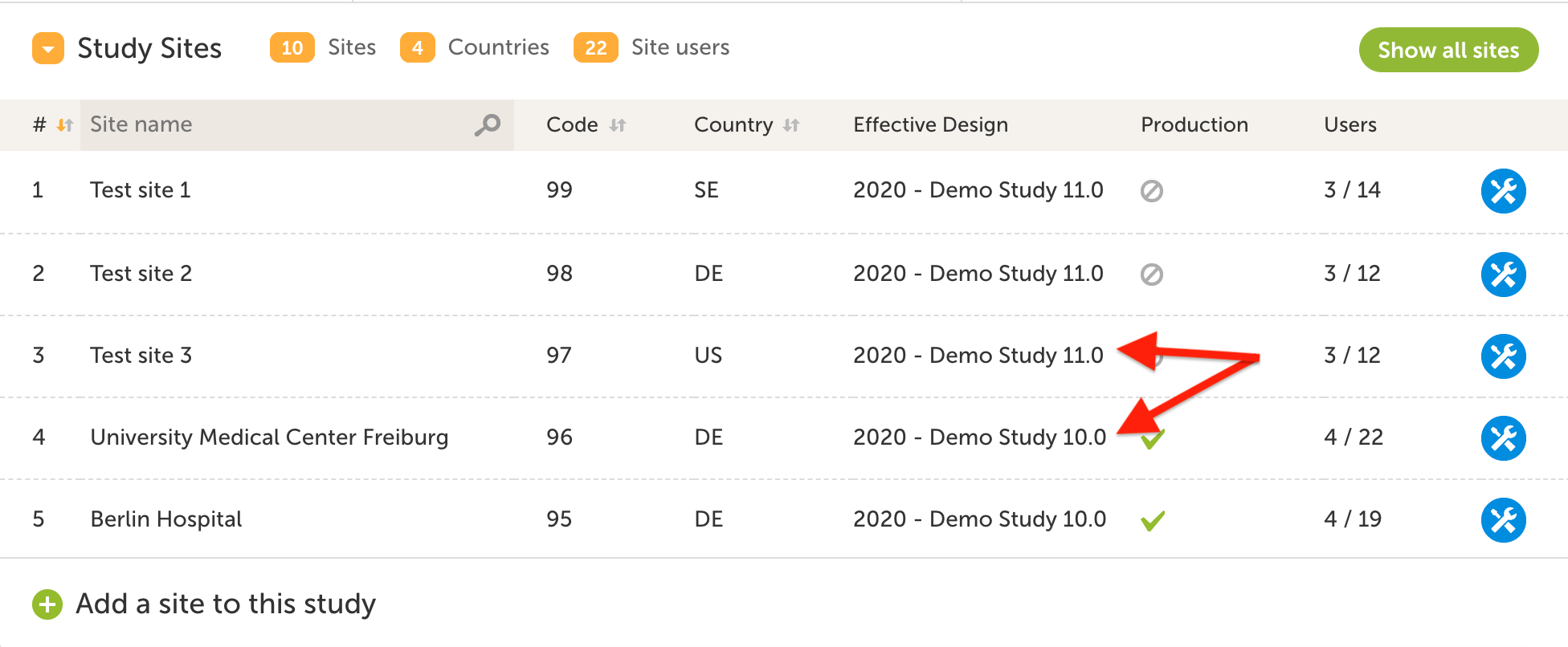
データアクセス
FDAは、データアクセスに関しては以下のように推奨しています。
- 治験依頼者はeCRFへのアクセス権限を持つ者のリスト化すべきである。
- トレーニング及び認可されたことを示す記録のある者のみがeCRFデータへのアクセス権を持つべきである。
- (アクセス権を持つ者が)治験への関与を終了した場合ログオンアクセスを無効にすべきである。
アクセス権を持つユーザーのリスト
Viedocでは、特定のユーザーロールページを介して、同じサイトにアクセスできる他のユーザーを確認することが可能です。このページでは、ユーザーの現在のアクセス状況、アクティビティ詳細、及びユーザーがデータの信頼性確保のためにデータに貢献したかどうかなど、サイト上で利用可能なすべてのユーザーのロールが一覧表示されます。この機能は、すべてのユーザーに対してデフォルトで有効になっており、FDAの指針にあるように、eCRFへのアクセス権を持つ者のリスト化をするべきだという要件を満たしています。
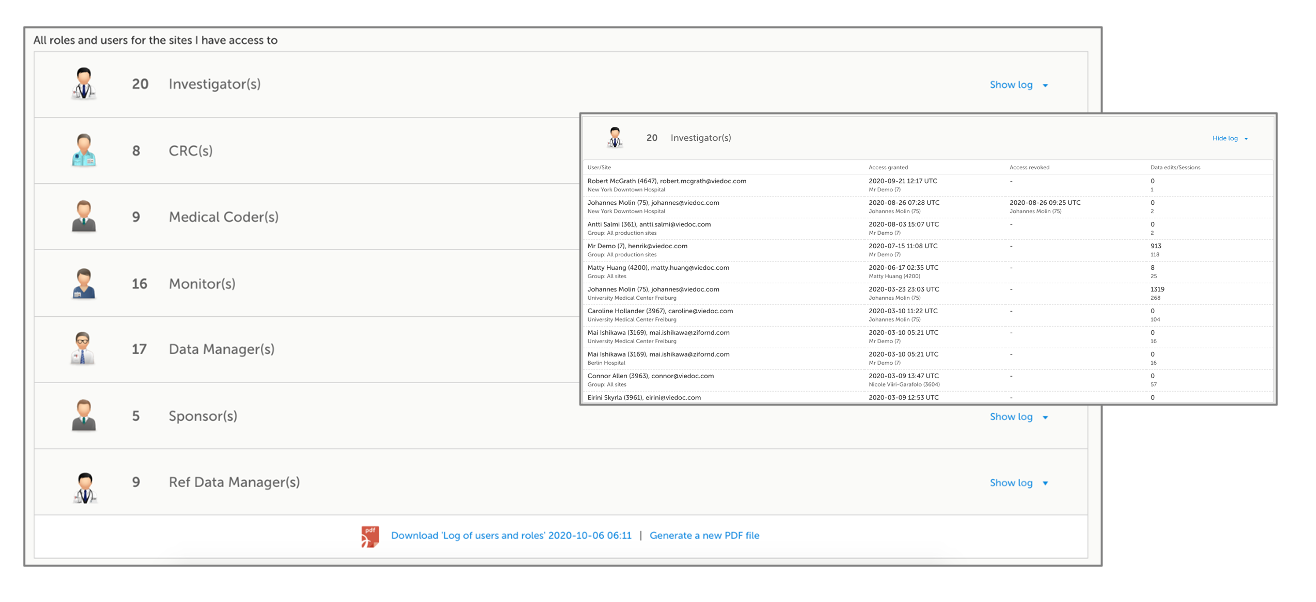
トレーニング記録
Viedoc Admin アプリケーションでの試験設定で、トレーニングを修了しその記録がなされたユーザーのみが eCRF データにアクセスできるようになっています。Viedoc利用者は、既存のViedocユーザーガイドを使用したり、独自のトレーニング資料を作成したり、関連文書やビデオへのリンクなどをアップロードして、各ユーザーロールに必要なトレーニングパッケージを作成することができます。
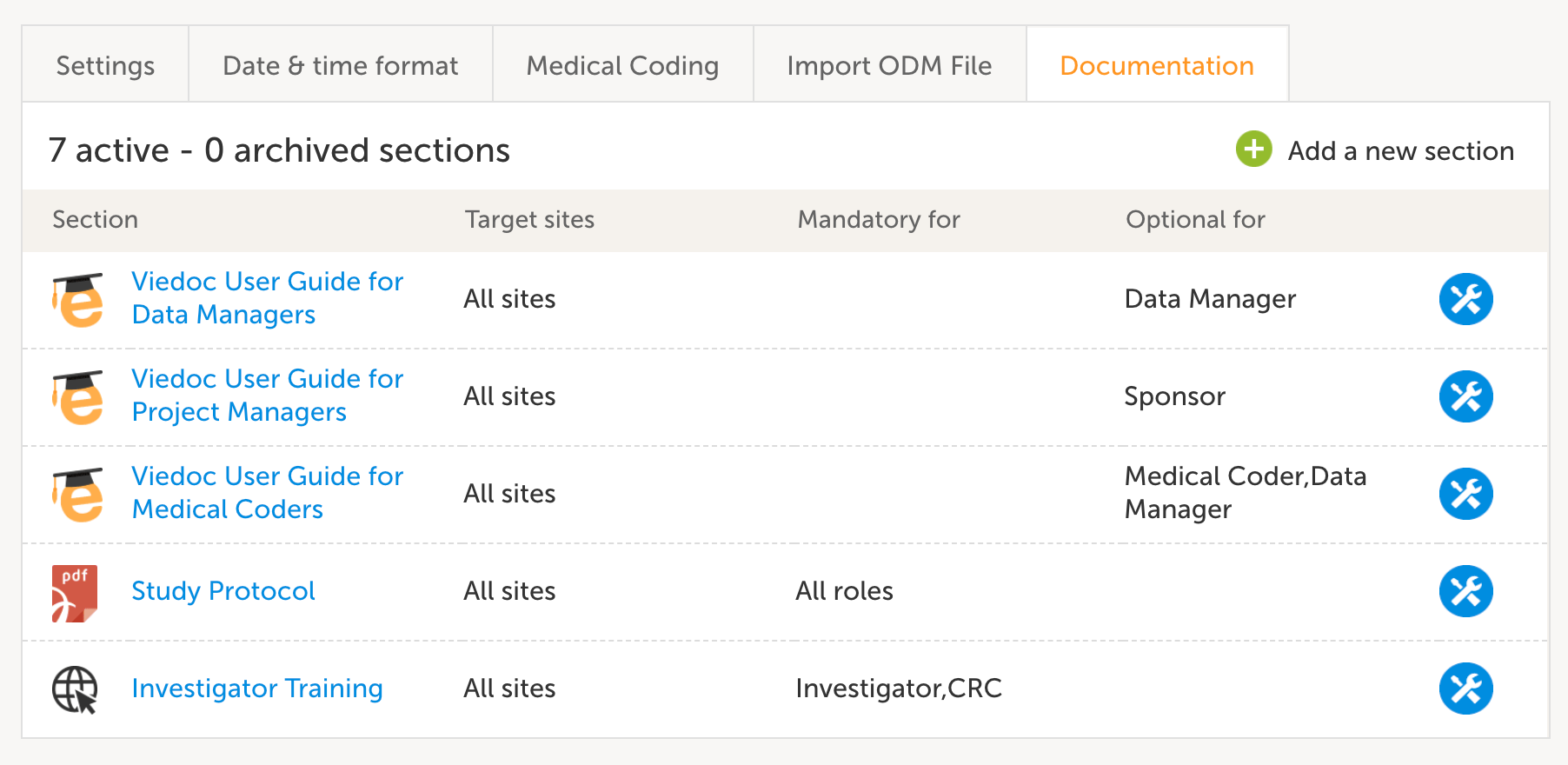
ログオンアクセス
試験への関与を終了したユーザーのアクセスを、Viedoc Adminでスタディマネジャー、またはサイトマネジャーが無効にできます。Viedoc利用者は、Viedoc Admin に直接アクセスできるように、各プロジェクトに 1 人または数人のスタディーマネージャーとサイトマネージャーを任命することができます。そうすることで、試験に精通した者がアクセスの問題をヘルプデスクに依存することなく、即座に解決することができます。ユーザーのアクセスは、ロールまたは試験レベルのいずれかで削除することができます。また、ユーザーはViedocの試験組織から完全に削除することもできます。
データプライバシー
臨床試験におけるデータの完全性、アカウンタビリティ、トレーサビリティという重要な概念を可能にするために義務付けられている不変の監査証跡は、治験依頼者がアクセス可能なデータ要素に個人を特定できる情報が誤って入力された場合、取り返しのつかないプライバシー侵害になる可能性があります。これに対するViedocのソリューションは、個人を特定できる情報を含むデータ値をマスク (匿名化)し、CRFから削除されたが、監査証跡ではまだ公開されているデータ値をサイトで匿名化することができるデータマスキング機能です。技術的には、監査証跡の上に設置されたフィルターであり、監査役や規制当局の審査官ではない者がそのフィルター下の情報を調べることができないようにします。
データの取扱い
Viedocには柔軟なデータ出力機能とレポート作成のインターフェイスがあり、業界スタンダードの様々な標準的なフォーマットを出力することができますが、そのうちの1つがPDFです。試験の過程で生成されたeCRFの同時コピーを、サイトでのドキュメンテーション要件を満たすためにEHRにアップロードすることができます。
規制
Viedocは、以下のような規制やガイドラインに準拠しています。
- ICH GCP E6 R2
- 21 CFR Part 11
- CSUCI
- FDA eSource Guidance
- EMA eSource Reflection Paper
- GMP Annex 11
- Japanese ER/ES Guideline and EDC Guidance
eSource DDCの管理に有用な機能
Viedocは、治験従事者ための実務の改善、容易にするためにデザインされ、開発されたブラウザベースのタブレット対応アプリケーションです。そのため、多くの機能が含まれています。以下では、eSource DDC の実際のパフォーマンスに関して有用な機能をいくつか紹介します。
ファイルアップロード
eSource DDCの使用で、治験責任医師と患者とのやりとりに悪影響があってはなりません。そのためには、eSourceツールの使用が簡易で、データの取り込みだけに限定されず、フリーテキストも同様に使用できることが重要です。ViedocでeCRFフォームをデザインする際、デザイナーは15のデザイン要素の中から選択することができ、そのうちの2つはフリーテキストとファイルのアップロードです。
同一フォームでの患者/イベント間のナビゲーション
eSourceデータが収集される場面で特に重要なのは、患者、ビジット、フォーム間の迅速かつ効率的なナビゲーションをサポートしているということです。Viedocのユーザーインターフェース、複雑なまたは頻繁に使用されるアクティビティの使い易さは、おそらく他システムとの明確な差が表れるところです。
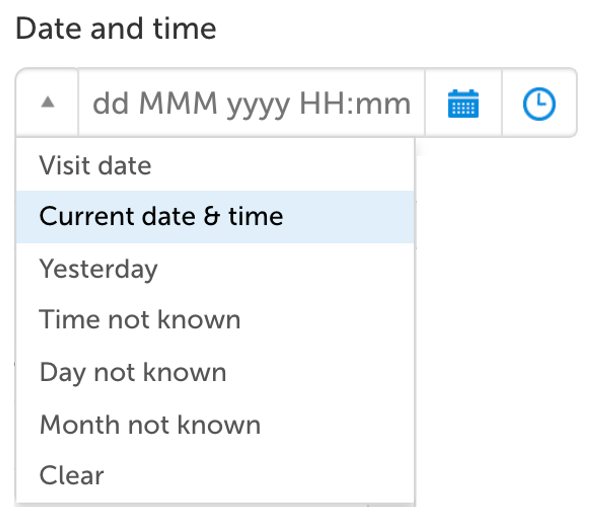
日時の収集
ワンクリックで日付や時間データを収集できることは、ViedocがeSourceデータを効率的に収集するためにサポートする多くの機能の1つです。
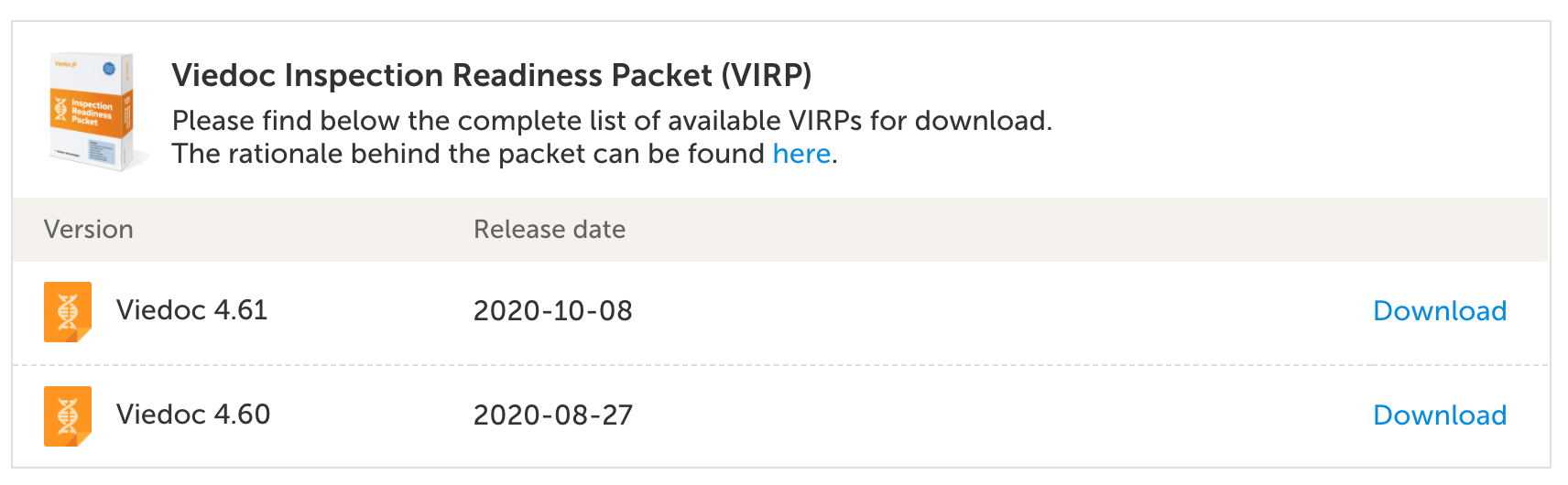
ドキュメンテーション
規制当局は、臨床試験で使用されたシステムに関する関連文書を確認できることを期待しています。 Viedoc利用者は、リリースごとに更新されるViedoc薬事審査準備パッケージ(VIRP)にアクセスできます。 このパッケージには、申請に必要な関連事項、スポンサーまたはCROが各自用意しなければならない事項、およびシステムサプライヤーが保持して問題のない事項に関する情報を提供します。