データに署名する
はじめに
データは治験責任医師が署名します。被験者の署名は、個々のフォーム、イベント、または署名コンソールを使用して試験全体で行うことができます。
署名の定義
サイトマネージャーの協力の下、スタディマネージャーは全Viedocユーザーが、システムで作成する全ての電子署名は従来の手書き署名と法的拘束力が同等であることを意図したものであるとの説明を受け、その旨を保証してもらう必要があります。 Viedocにおける署名の目的・意味は常に、FDA 21 CFR part 11のSection.11.50で言及されている「責任」にあたるものです。従って、署名者は入力されたデータに対する責任を認識していると見なされます。Viedocでは、署名された内容、署名者、署名日時について記録します。
署名コンソール
署名コンソールにアクセスするには、患者詳細画面に行き、画面右上の署名アイコンを選択します。
![]()
署名コンソールが開きます。

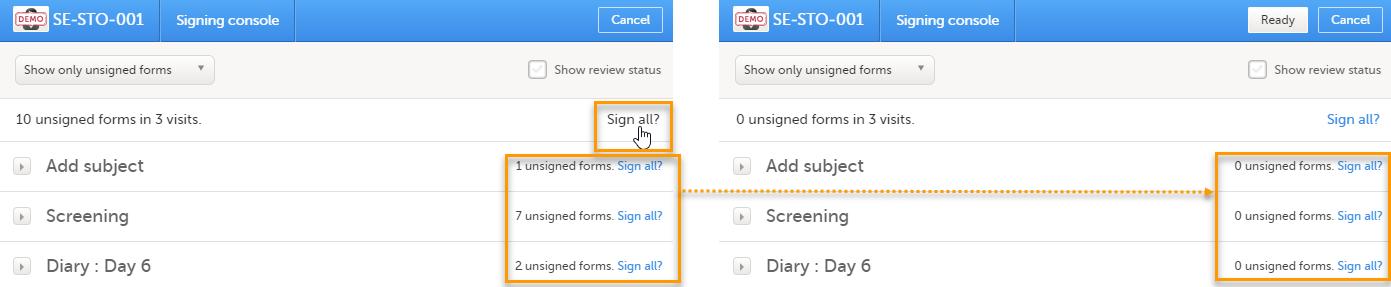
署名コンソールでは、選択した患者に対して、問題がなく、実施中の全てのフォームのリストをイベントごとに分類して表示します。
画面上部でフィルターをかけることができます。
- 全てのフォームを表示
- 未署名のフォームのみ表示
「目」のアイコンは、最新のフォームを閲覧済みかどうかを示します(フォームの最新バージョン)。
- 緑の目のアイコンはフォームの最新バージョンを閲覧済みを示します。
- グレイの目はまだ閲覧していないことを示します。
フォームをレビューするには、フォームバーを選択します。フォームを閉じると、再度署名コンソールに戻ります。
レビューステータス確認:
- CRA - 臨床研究アソシエイト (CRA) またはレビュー権限を持つ別の役割によるレビュー済み
- DM - データマネージャー (DM) またはレビュー権限を持つ別のロールによるレビュー済み
- SDV - ソースデータ検証 (SDV) を実施済み
各フォームのCRA、DM、SDVのステータスを確認するには、画面右上にあるレビュー状況を表示のチェックボックスにチェックを入れます。
データの署名には:
| 1 | 以下のいずれかの方法で、署名するフォームを決定します。
|
| 2 |
画面上部のバーにある完了を選択すると、確認ポップアップが表示されます。 このポップアップでは試験に適用される全ての規制を網羅した一般的なテキストを示しており、医師がデータに署名する際の、Viedocにおける署名の標準的な意味を説明しています。適用される規制は試験によって異なる為、医師に規制についてお伝えするのはスタディマネージャー・スタディコーディネーター(または施設の担当者)の責任範囲となります。 |
| 3 | パスワードを入力し、確認を選択します。 重要!連続で3回パスワードを間違えると、アカウントはロックされます。 |
注意!
予定されているイベントでも予定されていないイベントでも、試験開始イベント・フォーム($EVENT)が自動的なイベント日付を使用する際に除外されていても、カウントされます。
- 署名コンソールでは、イベントのカウンター(フォーム数)には$EVENTフォームが含まれます。このフォームを選択して署名することはできませんが、(被験者またはイベントの) すべてに署名を選択した場合は署名できます。
- 個別行事のフォームに署名する場合、$EVENT フォームに署名することはできません。このため、すべて署名されたように見えても、試験開始イベントに表示される署名シンボルは表示されません。
チュートリアル動画のデータの署名もあわせてご確認ください。