レポート
はじめに
Viedoc Reportsでは、スタンダードレポートとカスタムレポートを表示できます。ここでは、レポートとサブレポートの表示、データの検索、並び替え、フィルタリングを行うことができ、結果をさまざまな形式で出力できます。それぞれのレポートでは表示内容や利用できる機能が異なります。これらの詳細については、以下のセクションで説明します。
一般的な機能
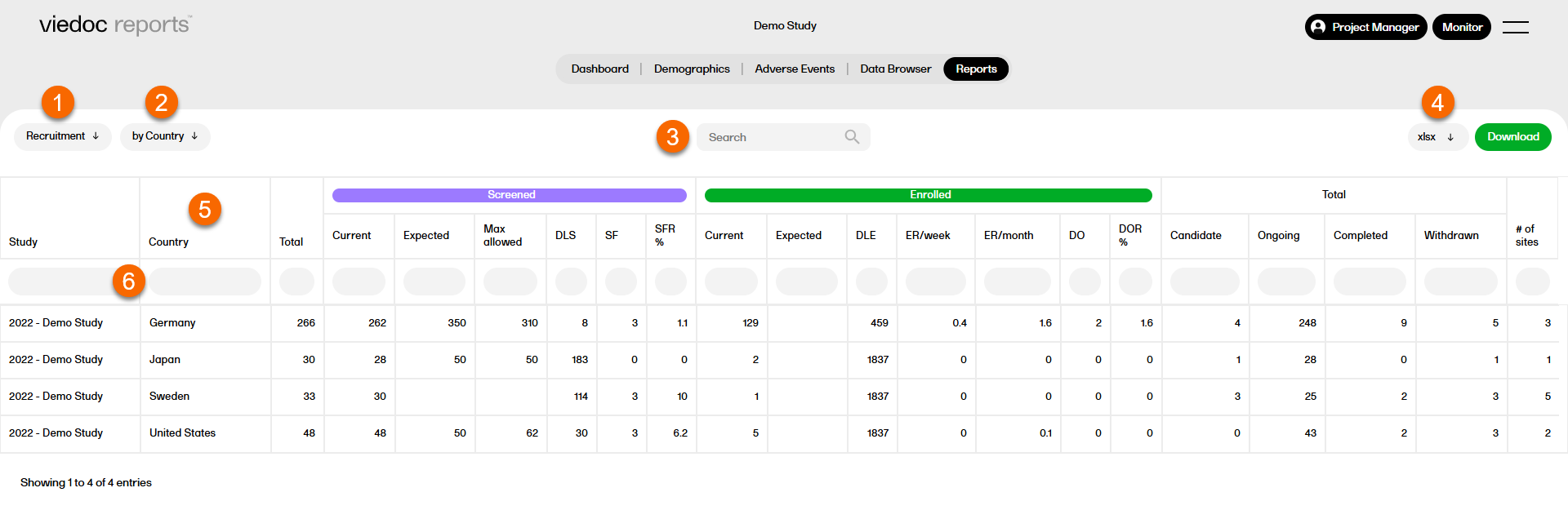
レポートページにおける機能の概要(レポートおよびサブレポート共通の標準機能):
1. ドロップダウンリストから任意のレポートを選択します。
2. サブレポートを選択します。
3. 検索フィールドで検索します。
4. ダウンロード形式を選択します。 詳しくは以下、 Reportsのダウンロードをご覧ください。
5. 列ヘッダーを選択すると、データを昇順または降順に並べ替えることができます。
6. 任意項目の下にある空白部分を選択すると、特定の範囲でデータをフィルタリングすることができます。xボタンを選択するとフィルタがリセットされます。
一般的なルールと定義
以下のセクションでは、すべてのレポートに適用される一般的なルールと定義について説明します。
- 削除された患者情報はカウントされず、レポートにも含まれません。
- 一般的な非表示フォームはカウントされ、レポートに表示されます。
- 特定のロールに対して非表示になっているフォーム情報は、その特定のロールが生成するレポートにはカウントされず表示されません。
- フォームは、開始または保留されたときにトリガーされたとみなされます。
- フォームは、開始されたイベント内にあり開始されていない場合、保留とみなされます。
注意! これは、すべてのイベントタイプに適用されます。
- フォーム上の少なくとも1つの項目が入力されている場合、フォームは開始されたとみなされます。
- Sequence Number (被験者連番)は、被験者IDとともにすべてのスタンダードレポートおよびサブレポートに含まれており、レポート間で被験者を一意に識別できるようにします。
出力バージョン
レポートでは、常に最新の出力バージョンが使用されます。新しい出力バージョンがリリースされた場合は、リリースノートを確認し、標準レポートまたはカスタムレポートに影響があるかどうか、またどのような影響があるかを確認してください。
スタンダードレポート
標準データに基づくレポートについて、以下のセクションで説明します。
ヒント! スタンダードレポートの多くは、カスタムレポートとして使用するためにダウンロードおよびカスタマイズできるようになりました。レポートスクリプトにアクセスするには、ViedocのGitHubにあるexample-standard-reportsリポジトリをご覧ください。
リクルートメント
リクルートメントレポートは、患者ステータスの詳細とともにリクルートメントデータを表示します。
リクルートメントレポートの詳細については、リクルートメントを参照ください。
レビューステータス
レビューステータスレポートには、レビューステータス(クリニカル、データ、ソースデータバリデーション(SDV)、署名、およびロック)の情報が表示されます。
レビューステータスレポートの詳細については、レビューを参照ください。
欠損データ
欠損データでは、欠損項目が表示されます。
欠損データレポートの詳細については、欠損データを参照ください。
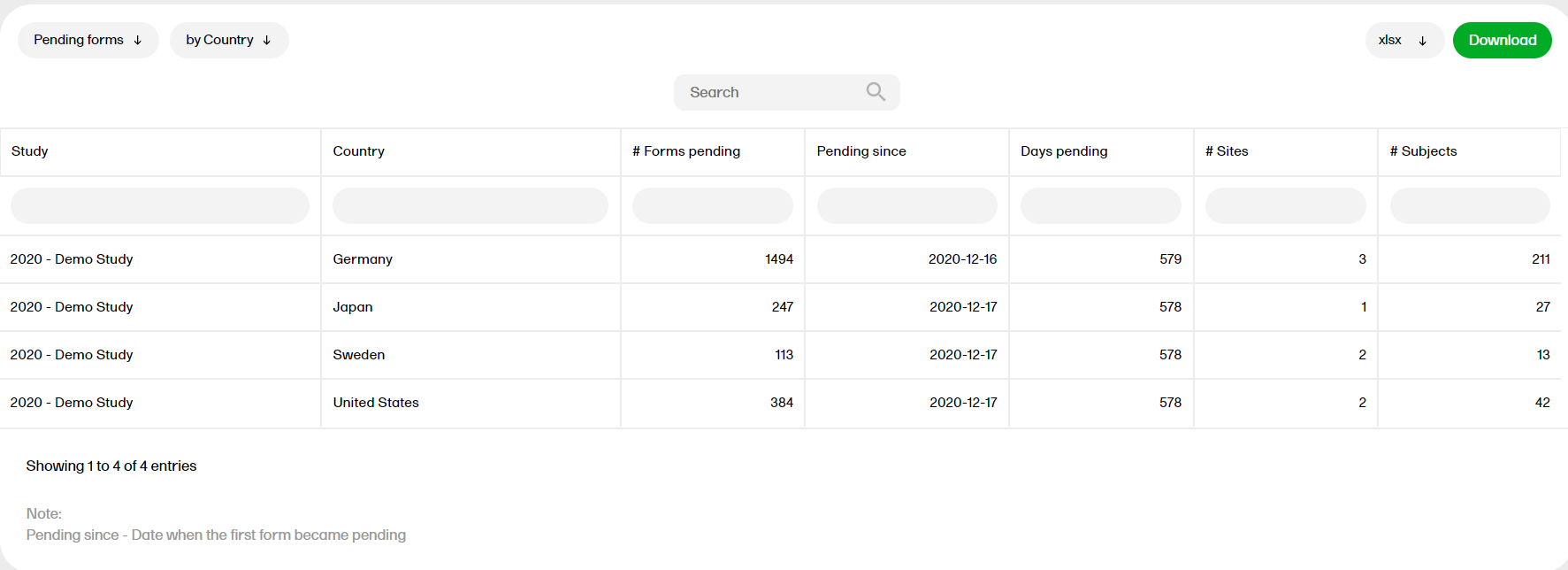
保留中のフォーム
保留中のフォームレポートには、保留中(未完了)のフォームが表示されます。フォームは、開始済みのイベント内で未開始の場合に、保留中とみなされます。これは、患者日誌(Viedoc Me)を含む、すべてのイベントに適用されます。繰り返しフォームでは、最初のインスタンスが未開始の場合、そのフォームは保留中とみなされます。フォームをリセットすると、そのフォームは保留中となります。
保留中のフォームレポートの詳細については、保留中のフォームを参照ください。
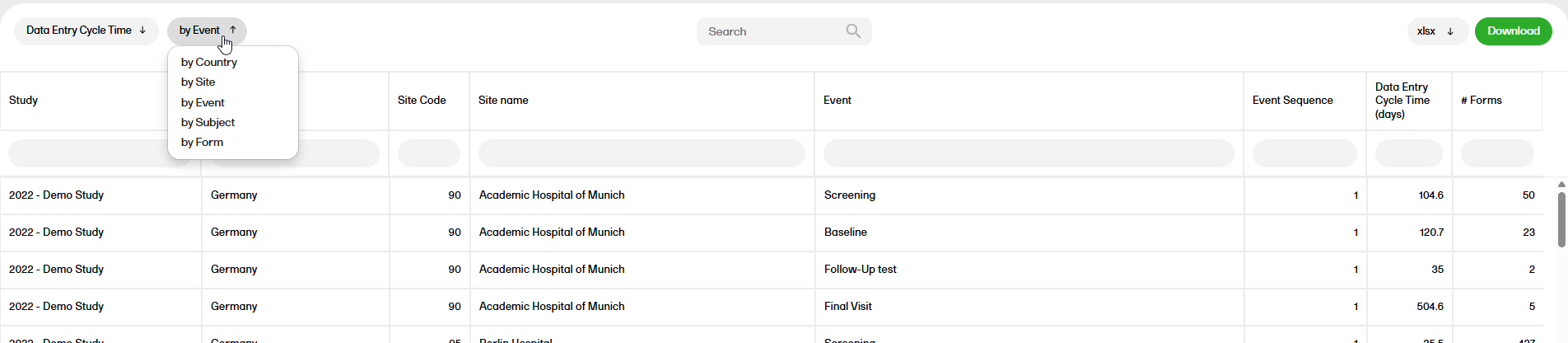
データエントリーサイクルタイム
データエントリー・サイクルタイムレポートには、施設でフォームデータを入力するのにかかる時間が表示されます。
データエントリー・サイクルタイムレポートの詳細については、データエントリサイクルタイムを参照ください。
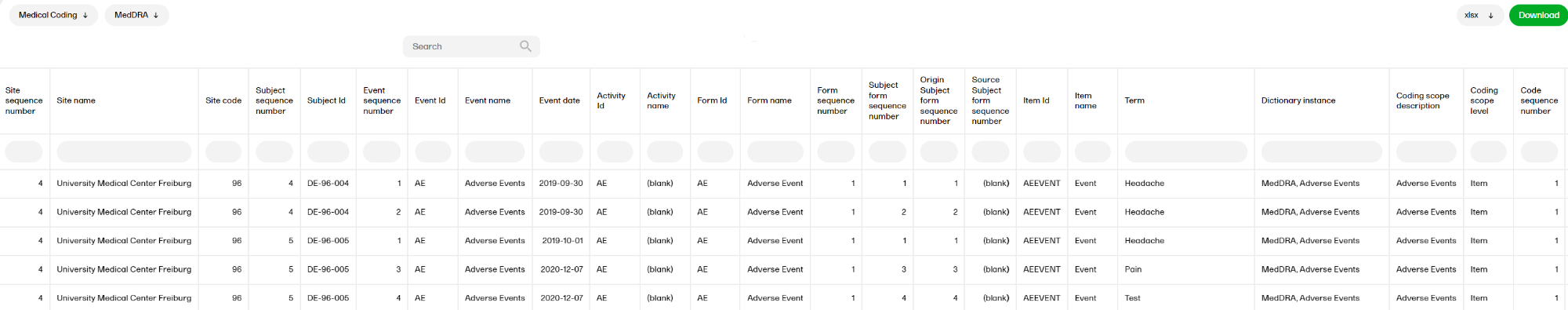
メディカル・コーディング
メディカル・コーディングレポートでは、コーディングされたデータを表示します。WHODrug、MedDRA、MedDRA_J、ATC without DDD、IDF の辞書のレポートを選択できます。
メディカル・コーディングレポートの詳細については、メディカル・コーディングを参照ください。
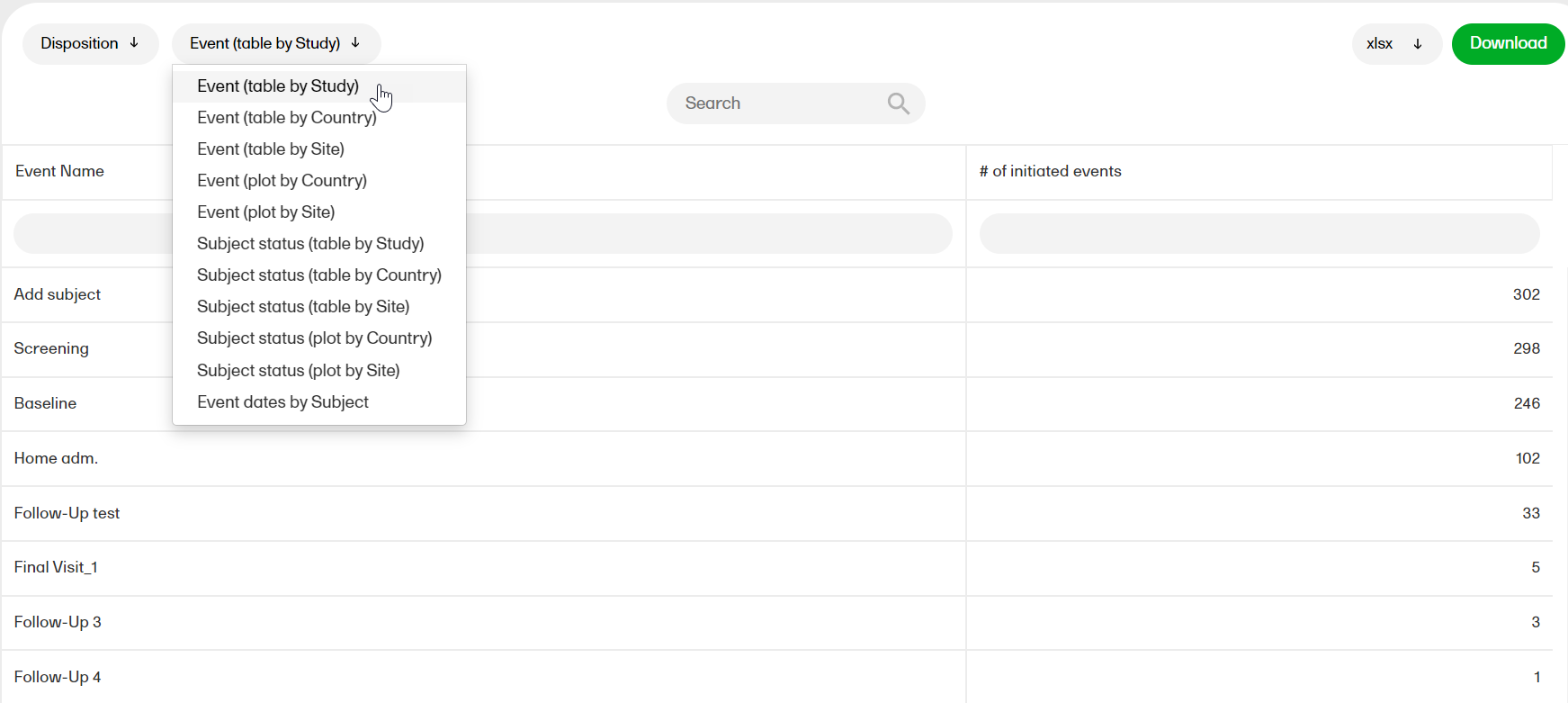
症例内訳
症例内訳レポートは、試験全体にわたる現在の症例ステータスの概要を示します。
症例内訳レポートの詳細については、症例内訳を参照ください。
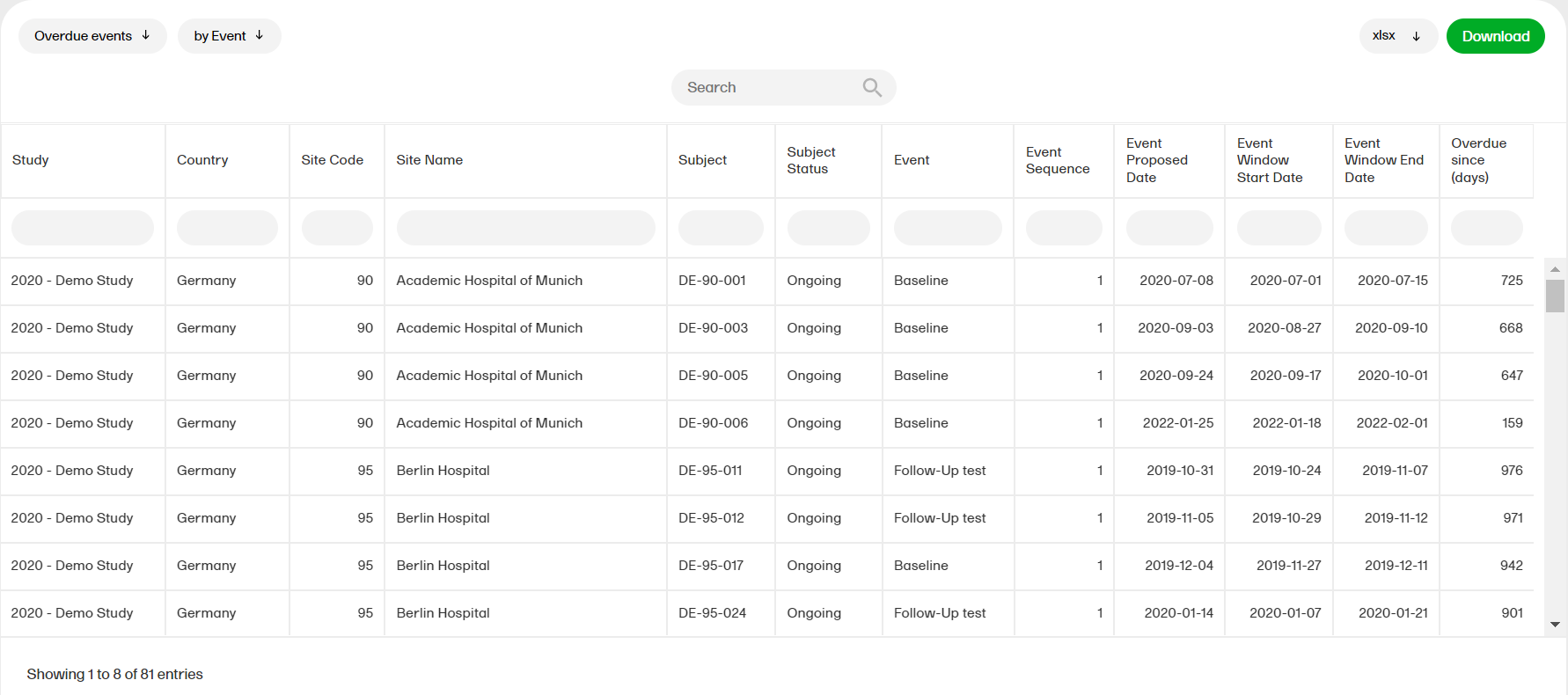
超過イベント
超過イベントのサブレポート、予定日とイベント、国別、施設別、件名別、イベント別は、予定日があり、イベント予定範囲終了日が過去の日付であるイベントを表示します。
超過イベントのレポートの詳細については、超過イベントを参照ください。
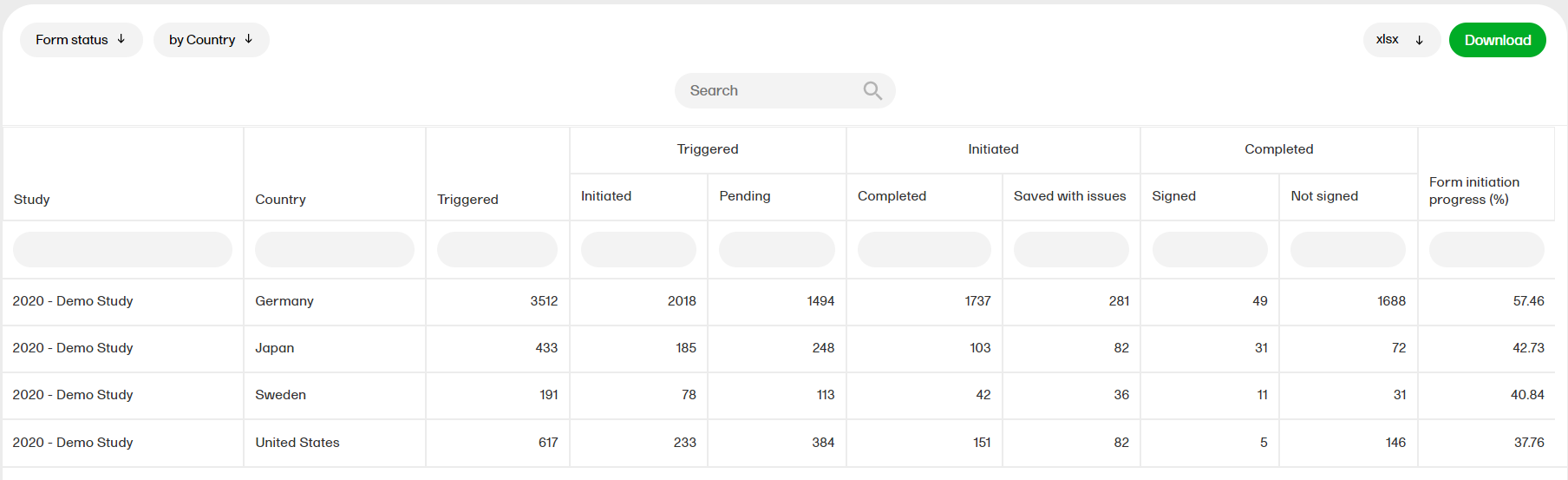
フォームステータス
フォームステータスレポートは、患者のステータス、例えば、開始、保留、完了、 問題有り、未署名などの概要を提供します。
フォームステータスレポートの詳細については、フォームステータスを参照ください。
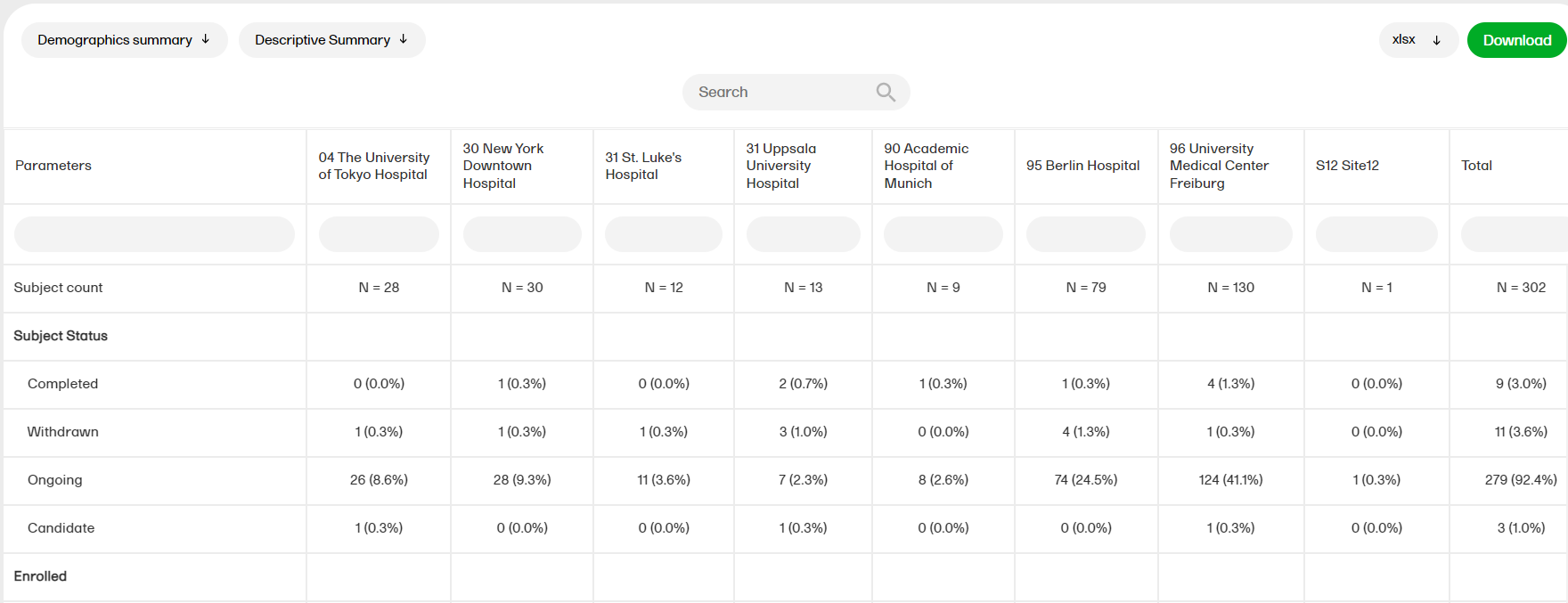
デモグラフィックまとめ
デモグラフィックまとめレポートでは 、デモグラフィックページの変数を使った表とパイチャートが表示されます。
デモグラフィックまとめレポートの詳細については、デモグラフィックまとめを参照ください
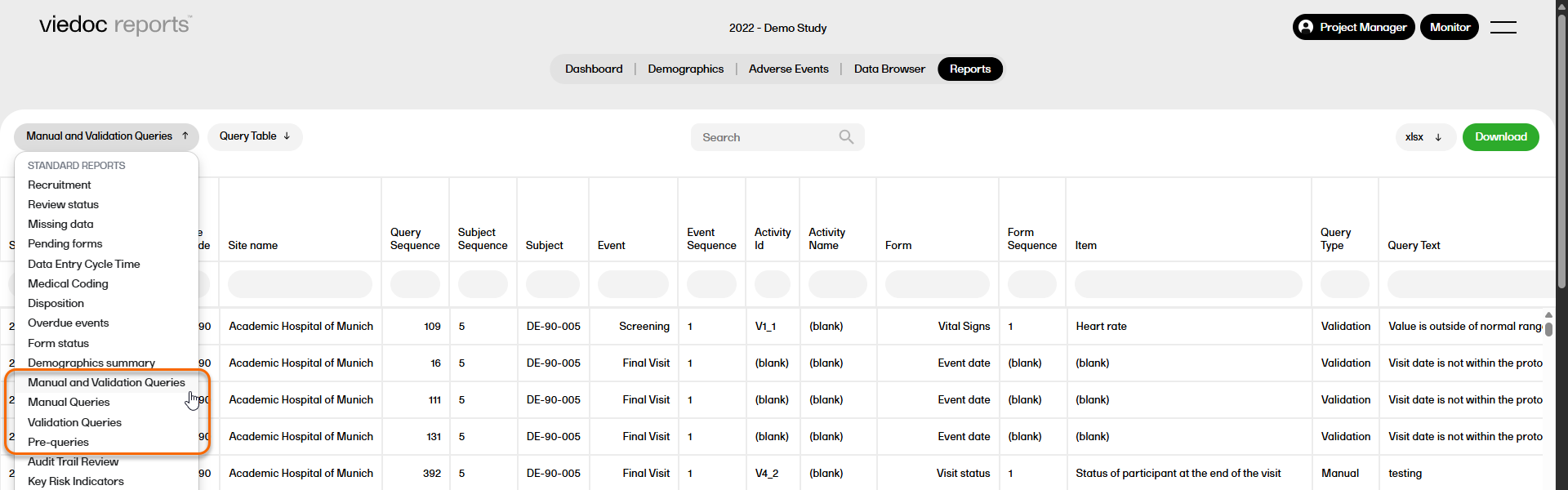
クエリレポート
試験全体にわたり、異なるレベルで詳細なクエリデータを表示する 4 種類のクエリレポート(手動および検証クエリ、手動クエリ、検証クエリ、プレクエリ)が利用可能です。
クエリレポートの詳細については、クエリレポートを参照してください。
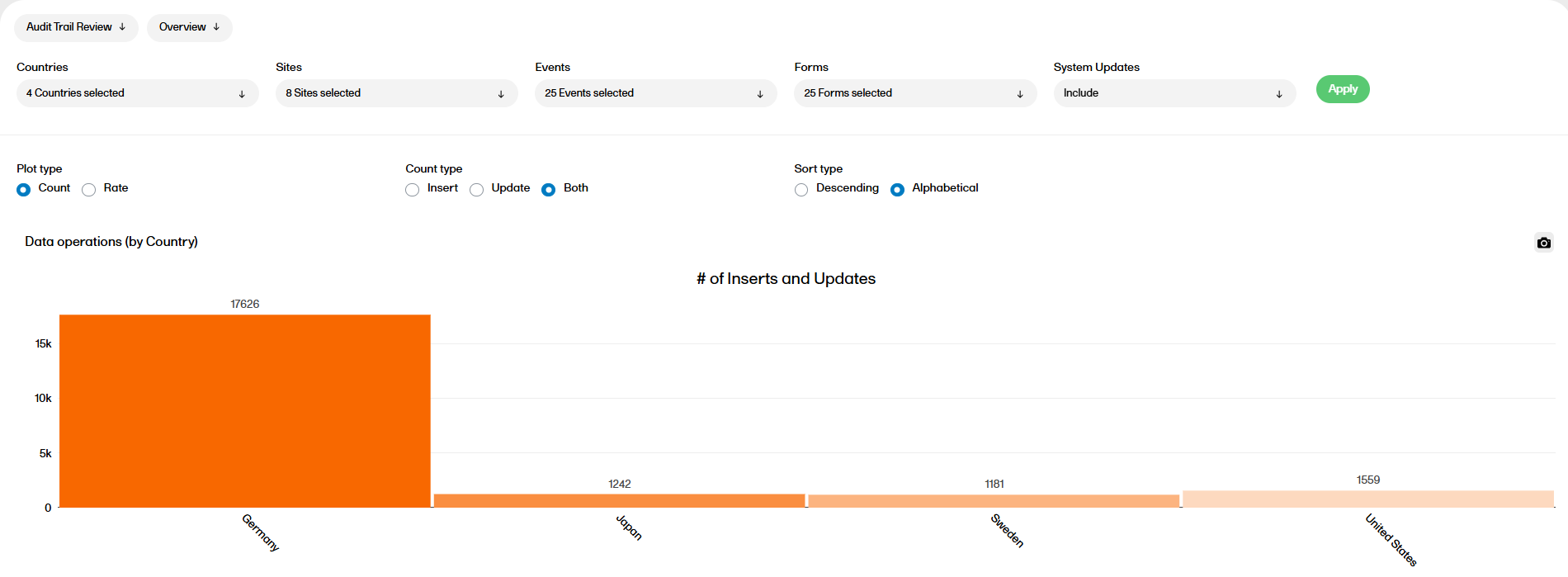
監査証跡のレビュー
監査証跡のレビューレポートでは、通常のデータ入力パターンとの逸脱や、一般的なパフォーマンスが表示されます。概要(Overview)と経時変化(Change over time)の2つのサブレポートから選択することができます。
監査証跡のレビューレポートの詳細については、監査証跡のレビューを参照ください。
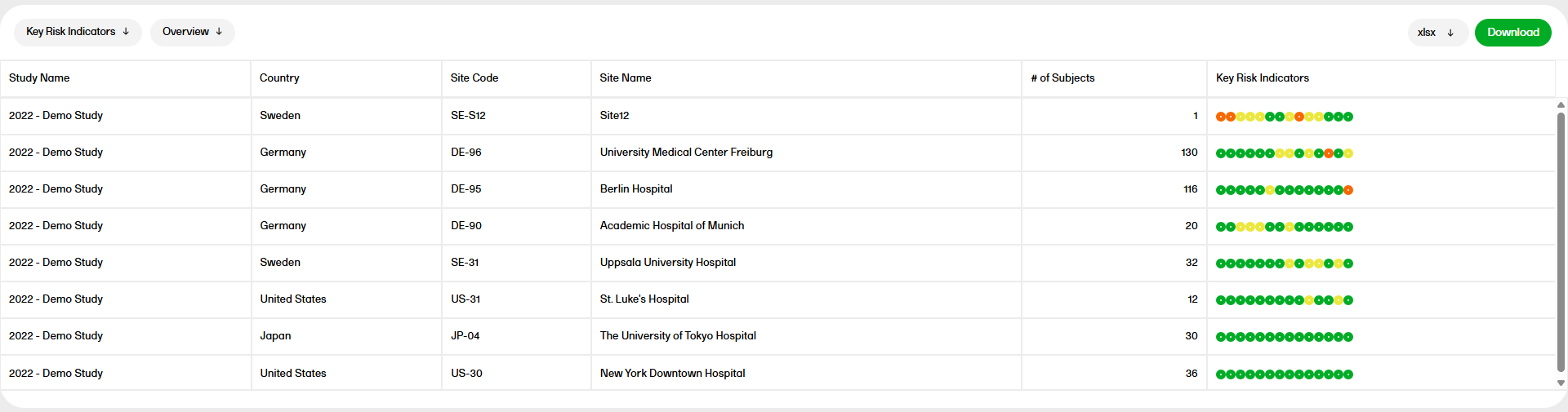
主要なリスク指標
主要なリスク指標 (KRI: Key Risk Indicator)レポートは、施設ごとの主要なリスク指標を簡単に把握することができます。このレポートには、概要(Overview)、施設別(by Site)、主要なリスク指標別(Key Risk Indicator)の3種類あります。
主要なリスク指標レポートの詳細については、主要なリスク指標を参照ください。
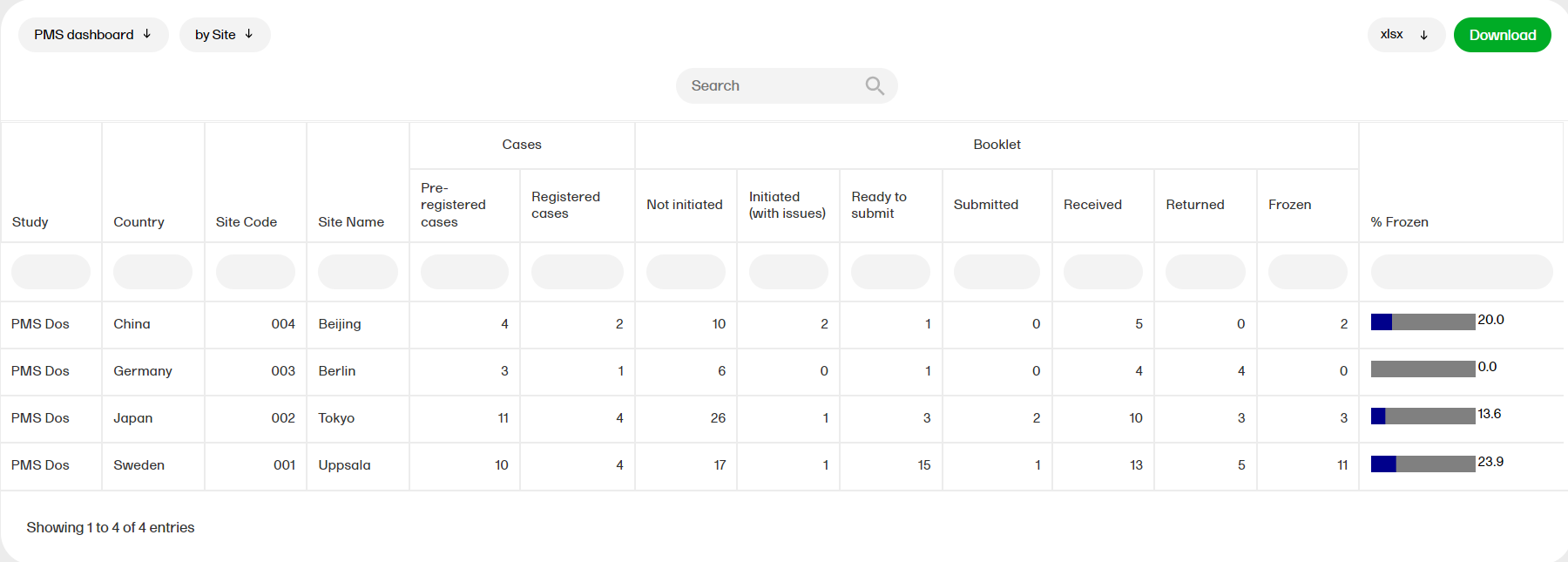
PMSダッシュボード
PMSダッシュボードはViedoc PMSをご利用の調査/試験のみで対象しており、以下のような分冊ステータスが表示されます。施設、症例、分冊、分冊履歴、タイムラプスにデータを分けることができ、それぞれ以下のカラムが表示されます。
by Site(施設別)
- Study(調査)、Country(国)、Site Code(施設コード)、Site Name(施設名)
- Casesカラムには、Pre-registered(仮登録数)及び、Registered subjects(登録済数) が症例ステータスから引用されています。
- Booklet (分冊)カラムには、Not Initiated(未実施)、 Initiated (with issues) 実施中(イシューフラグ有/オープンクエリ有)、Ready to submit(実施済/オープンクエリ無)、Submitted(送信済み)、 Received(開封済み)、 Returned(再調査依頼済み)、Frozen(固定済み)
分冊ステータス、仮登録症例数、登録症済み例数が施設レベルでまとめて表示されます。分冊固定の進捗状況を棒グラフでパーセンテージ表示します。
by Subject(症例別)
- Study(調査)、Country(国)、Site Code(施設コード)、Site Name(施設名)、 Subject(症例)、Subject added date(症例追加日) (subjectAddedDate.rds から引用)、Subject completed date(症例の完了日) (症例ステータスから引用)
- Booklet(分冊)カラムには、Not Initiated(未実施)、 Initiated (with issues) 実施中(イシューフラグ有/オープンクエリ有)、 Ready to submit(実施済/オープンクエリ無)、Submitted(送信済み)、 Received(開封済み)、 Returned(再調査依頼済み)、Frozen(固定済み)
分冊ステータスの概要および、症例追加日、症例完了日が症例レベルでまとめて表示されます。分冊固定の進捗状況を棒グラフでパーセンテージ表示します。
by Booklet(分冊別)
- Study(調査)、Country(国)、Site Code(施設コード)、Site Name(施設名)、 Subject(症例)
- Booklet(分冊)カラムには、 Booklet name(分冊名)、 Booklet sequence #(分冊シーケンスナンバー)、Current status(現在の分冊ステータス)、Last activity date(最新のアクティビティ日)、Booklet start date(分冊開始日)、Booklet end date(分冊完了日)
- Queries(クエリ)カラムには、# open queries(未解決クエリ数)、# resolved queries(承認済みクエリ数)、# closed queries(終了されたクエリ数)
現在の分冊ステータスと最新のアクティビティー日、および未解決、承認済み、クローズしたクエリ数を分冊レベルでまとめて表示されます。
by Booklet (history)(分冊履歴)
- Study(調査)、Country(国)、Site Code(施設コード)、Site Name(施設名)、Subject sequence #(症例シーケンスナンバー)、Subject(症例)、Subject added date(症例追加日)、Booklet name(分冊名)、 Booklet sequence #(分冊シーケンスナンバー)、 Booklet status(分冊ステータス)、Booklet Activity(分冊アクティビティ) Date & Time (UTC)(UTC日時)、User Name (ID)(ユーザーネーム・ID)
分冊ステータスの履歴が表示され、ユーザーは subjectAddedDate.rds ファイルから特定の日付と症例追加日をフィルタリングすることができます。
注意!Not Initiated (未実施)レコードは含まれません。
Timelapse(タイムラプス)
- Study(調査)、Country(国)、Site Code(施設コード)、Site Name(施設名)、 Booklet Submitted Lapse Days(分冊送信経過日)
- Queries(クエリ)カラムには、Resolved lapse days(承認からの経過日数)、 Closed lapse days(クローズからの経過日数)が表示されます。
各分冊ステータスの「開始日」と「最初の送信日」の間の経過を症例ごとにまとめたもので、承認済みおよびクローズ済みのクエリの日数経過も併せて表示されます。
注意!少なくとも1つの分冊が開始・送信されている症例のみが対象となります。さらに、症例においてのResolved(承認済み)とClosed(終了)のクエリ経過は、Queriesから引用されます。
カスタムレポート
Custom reports (カスタムレポート)に表示されるレポートは、当該試験に合わせて作成されたものです。カスタムレポートは、Viedoc Designer で設定されているユーザー権限にかかわらず、常にダウンロードが可能です。
ヒント!現在、いくつかのレポートテンプレートを R スクリプトとしてダウンロードし、カスタムレポートとしてカスタマイズできるようになっています。レポートスクリプトにアクセスするには、Viedoc の GitHub 上にある custom-reports repositoryをご覧ください。
データを表示する並び替えフィルターと列はレポートによって異なります。ここでは、カスタムレポート「DM Custom」にDemog1とDemog2(画像には表示されていません)の2つの列が含まれている例を示しています。
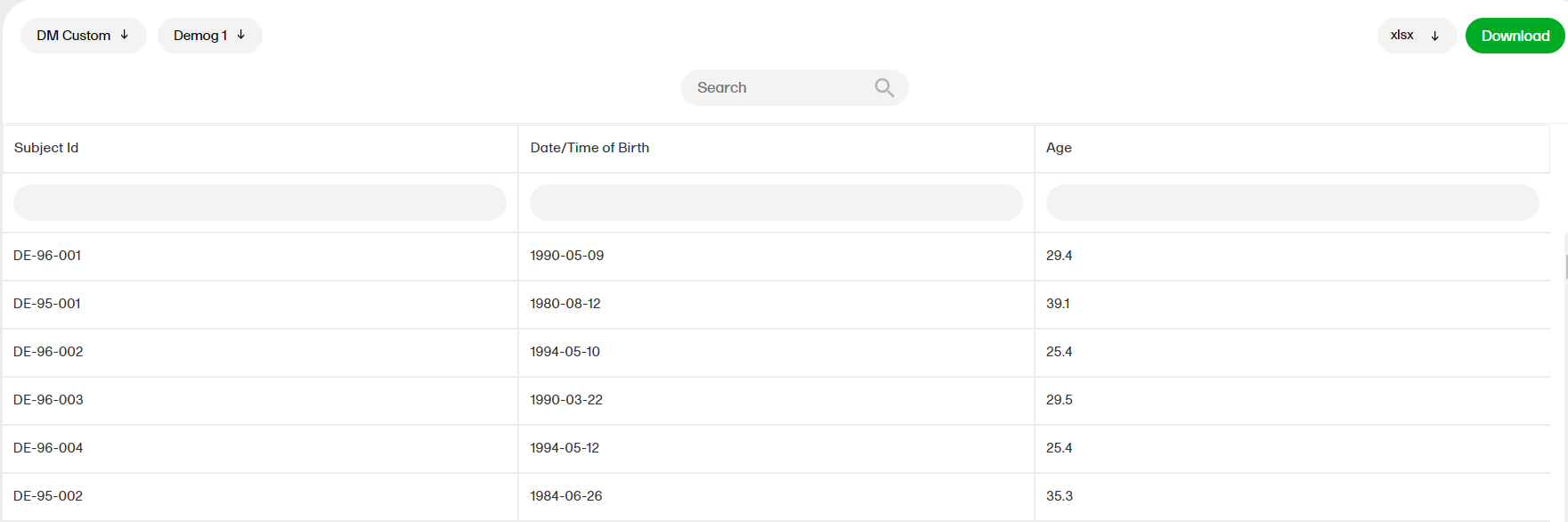
注意!レポートの一部の列が空欄になっている場合がありますが、これはCRFレベルでのユーザーロールの表示設定によるものです。
カスタムレポートの詳細については、カスタムレポートの作成を参照ください。
Reportsのダウンロード
レポートは以下のフォーマットでダウンロードできます。
- XLSX
- CSV
- XPT
- XPTV8
- RDS
- XML - カスタムレポート用、ただし以下の条件を満たす場合のみ:
- R スクリプトでレポート出力が XML として指定されている場合:
reportOutput <- list(「xml」 = new_xml_1) - 出力ファイルに
識別子が含まれている場合:validationCheck <- 「Identifier」 - レポート名にテキスト文字列「
E2B」が含まれている場合
- R スクリプトでレポート出力が XML として指定されている場合:
詳細については、カスタムレポートをご覧ください。
注意!
- Reportsで行われた並び替えはエクスポートには反映されませんのでご注意ください。
- ファイルをダウンロードできるのは、ユーザーロールにエクスポート権限が設定されているユーザーのみです。
ファイル名の構造は以下のようになります。
[STUDYNAME_REPORTNAME_DATE/TIMESTAMP.FORMAT]
サブレポートがある場合はファイル名は以下のようになります。
[STUDYNAME_REPORTNAME_SUBREPORT_DATE/TIMESTAMP.FORMAT]
[DATE/TIMESTAMP] は、以下のような構造になります。
[YYYYMMDDHHMMSS] は、Viedocからデータがデイリーで行われるデータ同期された日時です。
ファイル名の例: "DemoStudy2020_Review status_20200903220345.csv"
ダウンロード方法
レポートページでレポートをダウンロードするには、2つの方法があります。選択したスタンダードレポートをダウンロードする方法と、すべてのスタンダードレポートを一括でダウンロードする方法があります。
選択したスタンダードレポートからデータをダウンロードする方法:
| 1. |
スタンダードレポートドロップダウンメニューからダウンロードする特定のレポートを選択します。以下の例では、リクルートメントが選択されています。 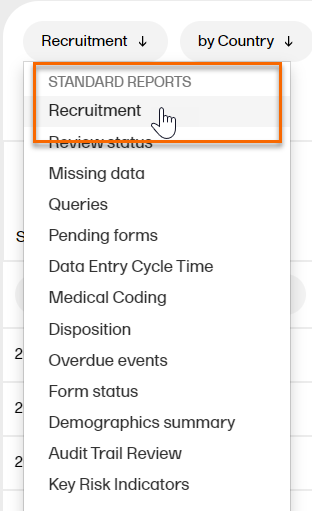 |
| 2. |
設定ダイアログで、ドロップダウンメニューからDownload selected subreportを選択します。 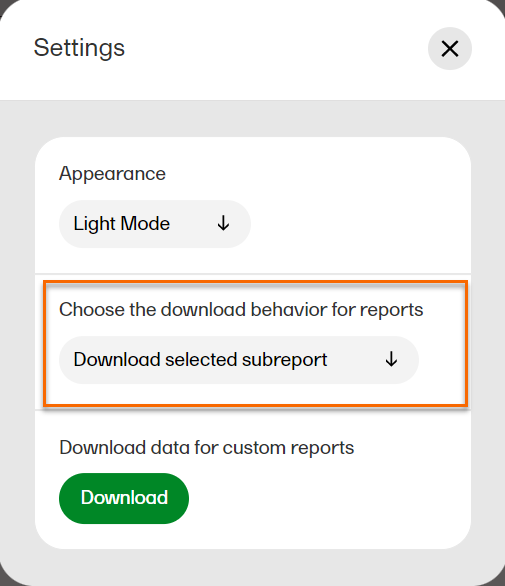 |
| 3. |
1. ダウンロードするフォーマットを選択します。 2. ダウンロードをクリックします。  |
すべてのスタンダードレポートを一括でダウンロードする方法:
| 1. |
設定ダイアログで、ドロップダウンメニューからDownload all subreportsを選択します。 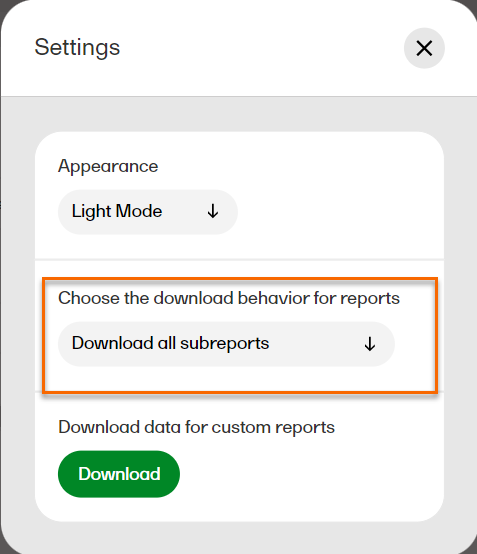 |
|
2. |
1. ダウンロードするフォーマットを選択します。 2. ダウンロードをクリックします。
ファイル名の例:Demo Study_Recruitment_202203230002854.xlsx
ファイル名の例:Demo Study_Recruitment_by Country_20220329230643.rds
|
注意!
- Key risk indicator レポートは、サブレポートで利用可能なユーザー選択により、デフォルトで Download selected subreport というダウンロード方法があります。
- 監査証跡レビューレポートには、ダウンロード機能はありません。
データの同期
Viedoc Reportsが同期しなくなる可能性があります。Viedoc Reportsが同期から外れた場合、以下の手順で同期ジョブをリセットし、再開することをお勧めします。
1. Viedoc Admin/Study設定でViedoc Reportsを無効にする。
2. 1時間待つ。
3. Viedoc Admin/Study 設定で Viedoc Reports を有効にします。
同期がリセットされ、再び開始されます。Viedoc Reportsに正しいデータが表示されるはずです。問題が解決しない場合は、Viedoc担当者にお問い合わせください。
